(全文25017字,阅读约需要63分钟,谨慎阅读)
流行病学
根据《2022年中国阿尔茨海默病报告》,2019年我国约有1314万AD患者;预计到2050年,这一数字将超过2800万。2021年国际阿尔茨海默病协会(ADI)发布的《世界阿尔茨海默病报告》称全球有5200万人患阿尔茨海默相关疾病,预测到2030年全球患病人数将达到7800万人。并预计3/4的AD患者未诊断。
近三十年来,中国人口迅速老龄化,神经退行性疾病的患者显著增加,尤其是阿尔茨海默病和相关痴呆(ADRD)。阿尔茨海默病(AD)的发病率和死亡率快速上升,目前已成为中国城乡居民中排名第五的死因,给个人、家庭和社会带来了沉重的经济负担。
2019年ADRD的年龄标化发病率是788.3/100 000(664.6-912.8),并且存在一定的年龄差异。2019年ADRD的年龄标化死亡率是23.3/100 000(5.7-61.3),略高于全球水平。
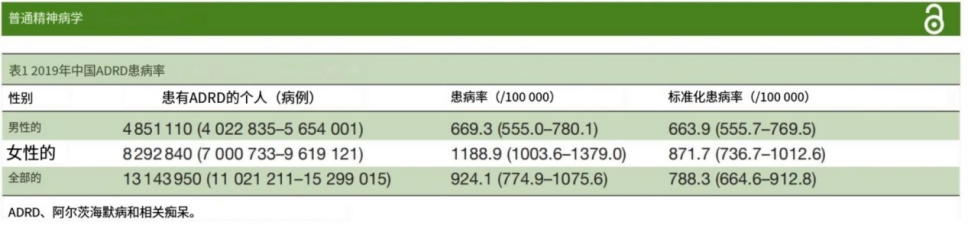
机翻凑合看
在过去的30年里,中国的AD死亡排名从1990年的第10位上升到2019年的第5位,尽管年龄标准化死亡率下降了0.39%。从1990年到2019年,中国ADRD的疾病负担从第27位上升到第15位,年龄标准化DALY增加了5.7%。
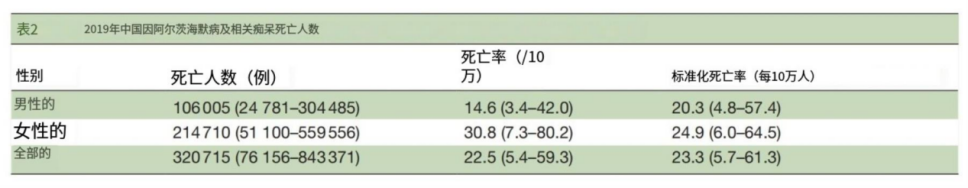
疾病概述
阿尔茨海默氏病(AD),也简称为阿尔茨海默氏症,是一种慢性神经退行性疾病,最初由德国精神病学家和病理学家Alois Alzheimer在1906年描述,后来以其命名。通常随着时间的推移开始缓慢并逐渐恶化。这是60-70%的痴呆病例的原因。最常见的早期症状是难以记住最近发生的事件。随着疾病的进展,症状可能包括语言问题,迷失方向(包括容易迷路),情绪波动,失去动力,不管理自我护理和行为问题。随着一个人的病情下降,他们经常退出家庭和社会。渐渐地,身体功能丧失,最终导至死亡。虽然进展速度可能不同,但诊断后的典型预期寿命为3至9年。

(右图:AD患者的大脑皮层萎缩、脑室扩大)
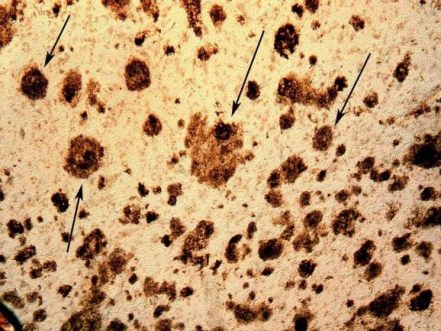
(箭头:淀粉样斑块)
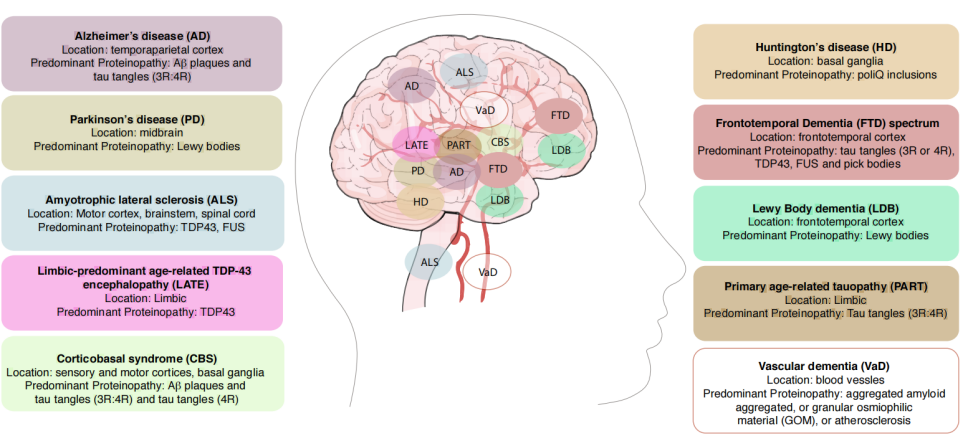
痴呆分类简表
造成痴呆的原因有多种,参考国际阿尔茨海默报告痴呆分类见下表,阿尔茨海默症是造成痴呆的主要病因。
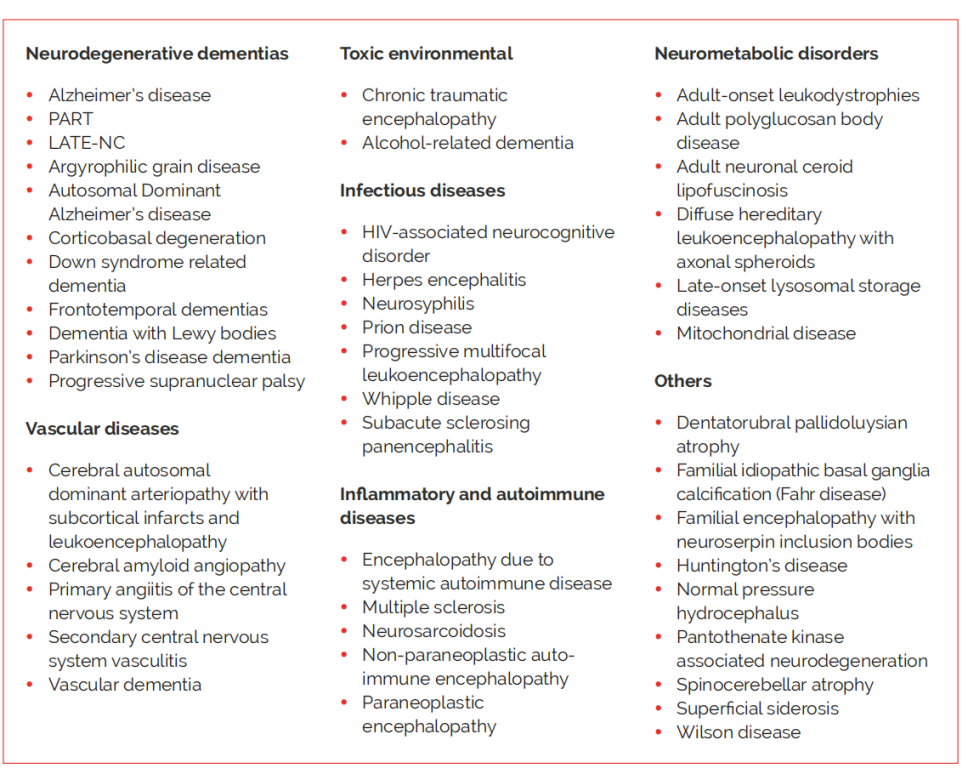
对应疾病名称
分类 | 疾病 | 中文 |
Neurodegenerative dementias |
| 神经退行性痴呆 |
| Alzheimer’s disease | 阿尔茨海默病 |
| PART (Primary age-related tauopathy) | 原发性年龄相关性肌腱病 |
| LATE-NC (Limbic-predominant age-related TDP-43 encephalopathy neuropathological change ) | 以边缘为主的年龄相关性TDP-43脑病的神经病理改变 |
| Argyrophilic grain disease | 嗜银粒病 |
| Autosomal Dominant Alzheimer’s disease | 常染色体显性阿尔茨海默病 |
| Corticobasal degeneration | 皮质基底变性 |
| Down syndrome related dementia | 唐氏综合征相关痴呆 |
| Frontotemporal dementias | 额颞部痴呆 |
| Dementia with Lewy bodies | 伴路易小体痴呆 |
| Parkinson’s disease dementia | 帕金森病 |
| Progressive supranuclear palsy | 痴呆和进行性核上麻痹 |
Vascular diseases |
| 血管疾病 |
| Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy | 脑常染色体显性动脉病伴皮质下梗死和白质脑病 |
| Cerebral amyloid angiopathy | 大脑淀粉样血管病 |
| Primary angiitis of the central nervous system | 原发性中枢神经系统血管炎 |
| Secondary central nervous system vasculitis | 继发性中枢神经系统血管炎 |
| Vascular dementia | 血管性痴呆 |
Toxic environmental |
|
|
| Chronic traumatic encephalopathy | 慢性创伤性脑病 |
| Alcohol-related dementia | 酒精相关性痴呆 |
Infectious diseases |
| 感染性疾病 |
| HIV-associated neurocognitive disorder | hiv相关的神经认知障碍 |
| Herpes encephalitis | 疱疹脑炎 |
| Neurosyphilis | 神经梅毒 |
| Prion disease | 朊病毒病 |
| Progressive multifocal leukoencephalopathy | 进行性多灶性白质脑病 |
| Whipple disease | 惠普尔病 |
| Subacute sclerosing panencephalitis | 亚急性硬化性全脑炎 |
Inflammatory and autoimmune diseases |
| 炎症性和自身免疫性 疾病 |
| Encephalopathy due to systemic autoimmune disease | 由系统性自身免疫性疾病引起的脑病 |
| Multiple sclerosis | 多发性硬化症 |
| Neurosarcoidosis | 神经类肉瘤病 |
| Non-paraneoplastic auto immune encephalopathy | 非副肿瘤性自身免疫性脑病 |
| Paraneoplastic encephalopathy | 副肿瘤性脑病 |
Neurometabolic disorders |
| 神经代谢紊乱 |
| Adult-onset leukodystrophies | 成人发病的白质营养不良症 |
| Adult polyglucosan body disease | 成人聚葡萄糖体病 |
| Adult neuronal ceroid lipofuscinosis | 成人神经元蜡样质脂褐质沉积症 |
| Diffuse hereditary leukoencephalopathy with axonal spheroids | 弥漫性遗传性白质脑病 |
| Late-onset lysosomal storage diseases | 晚发性溶酶体储存疾病 |
| Mitochondrial disease | 线粒体病 |
Others |
|
|
| Dentatorubral pallidoluysian atrophy | 齿状上睑苍白球萎缩 |
| Familial idiopathic basal ganglia calcification (Fahr disease) | 家族性特发性基底神经节钙化(Fahr病) |
| Familial encephalopathy with neuroserpin inclusion bodies | 家族性脑病伴神经蛇形蛋白包涵体 |
| Huntington’s disease | 亨廷顿氏症 |
| Normal pressure hydrocephalus | 正常压力脑积水 |
| Pantothenate kinase associated neurodegeneration | 泛酸激酶相关的神经退行性变 |
| Spinocerebellar atrophy | 脊髓小脑萎缩 |
| Superficial siderosis | 浅表铁屑病 |
| Wilson disease | 威尔逊氏病-肝豆状核变性 |
下图总结了与认知能力下降和痴呆相关的血管异常和蛋白质疾病
发病机制假说
1、ß淀粉样蛋白(Amyloid protein,Aß)沉积
正常情况下,神经细胞产生低浓度 Aß,Aß来源于淀粉样前体蛋白 (amyloid precursor protein,APP) 的水解。APP 的分解途径有“分泌酶分解途径”和“溶酶体分解途径”[3],分泌酶分解途径发生在细胞膜表面,共有 3 条途径,分别由分泌酶 a、ß、y 作用完成。AßPP 是一种跨膜糖蛋白,正常情况下被 a 分泌酶水解,生成可溶性分泌型 APP(sAßPP),sAßPP 可由组织正常分泌,它可以刺激细胞增殖、促进细胞间和基质的黏附,保护神经元免受兴奋性毒素和氧化反应损伤。ß和 y 分泌酶可分别在细胞膜外或跨膜部分将 AßPP 水解成一完整长度的可溶性 A,溶解状 AßPP 通过 G 蛋白干预细胞内信号过程,增加微管相关蛋白激酶的活性。不同因素都可以影响 AßPP 的水解方式。通过调节 AßPP 的 3 条途径,如增加 a 分泌酶的活性、减少ß和 y 分泌酶途径,可以减轻 Aß神经毒性作用。此外,发生 APP 基因突变及过表达时,可以扰乱自身的调节机制,当 APP 表达超过其正常途径的代谢能力时,可导至 APP 通过其他途径如溶酶体途径分解,产生大量 Aß,脑间质进行性堆积不溶解的 Aß沉积形成弥散斑块 [4] 从而在 AD 形成的病理过程中发挥作用。Aß能自发快速聚集形成ß- 片层折叠结构,进而形成纤维沉积导至 SP 发生,所以 Aß是 SP 的核心物质。一般认为 Aß浓度过高、ß折叠和纤维形成是具有神经毒性作用的基础。
脑内 Aß作为一种炎症刺激因子,可以活化补体、触发胶质细胞反应变化,释放强烈的神经毒性产物如氧自由基、过量谷氨酸盐及细胞因子、趋化因子、黏附分子等炎性蛋白的表达 [5]。其中氧自由基可引起细胞膜脂质过氧化物生成增多,破坏细胞膜功能,使细胞膜通透性增加,细胞外钙离子进入细胞内,激活钙依赖性蛋白酶、脂酶、激酶,使细胞内自由基生成增多,这些坃能损伤细胞器、细胞膜和细胞骨架,从而引起细胞死亡 [6]。此外,自由基还可激活小胶质细胞进而加剧氧化应激,Aß是氧化应激与 AD 脑神经细胞死亡之间的耦联分子。自由基还可促进 APP 裂解生成 Aß增加,二者具有相互促进效应 [7]。
2、tau 蛋白与神经元纤维缠结
除上述中由 Aß沉积形成的 SP 外,NFT 是 AD 的另外一个主要损伤,它是由神经原纤维异常聚集而形成的,其主要成分是以成对双螺旋丝样结构(paired helical filament,PHF)形成聚集的异常磷酸化的 tau 蛋白。tau 蛋白是人脑中正常存在的磷蛋白,相对分子量 50000-65000,正常的 tau 蛋白位于轴索中和神经元胞体。人 tau 蛋白的基因定位于 17 号染色体 17q21, 通过不同的 mRNA 剪切方式可产生从 351 到 441 个氨基酸的 6 种不同长短的异形体。在体内 tau 蛋白可稳定已组装的微管,在微管间形成横桥连接相同的微管,并同其他细胞骨架系统一起保障细胞内物质运输。当 tau 蛋白发生高度磷酸化、异常糖基化、异常糖化以及泛素蛋白化时,tau 蛋白失去对稳定微管的束缚, 神经纤维退化, 产生 AD[8]。
3、中枢神经递质代谢障碍
AD 患者脑内神经递质代谢障碍是重要的病理特征。其中胆碱能损伤学说是目前较为公认的:AD 患者皮质的胆碱能系统发生严重的溃变,引起学习记忆减退和认知障碍,产生痴呆症状 [9]。正常基底前脑的胆碱能神经元(主要位于基底核、斜角带核和内侧隔核)合成大量乙酰胆碱经投射纤维输送至大脑皮质和海马,乙酰胆碱被认为与学习和记忆有关,而海马是学习记忆的重要解剖基础,前脑胆碱能神经元的退变以及皮质和海马 Ach 的减少是 AD 的突出特征,从而导至以记忆和识别功能障碍为主的多种临床表现。在 APP23 转基因小鼠脑内存在胆碱能的变化 [10]。同时实验表明, 胆碱酯酶抑制剂对 AD 的治疗具有长期稳定的效果 [11]。神经化学的研究发现,乙酰胆碱改变区域有选择性,在 AD 患者脑中,胆碱能系统中有关酶亦有受累,颞中回、顶叶和额叶皮质及海马中的胆碱乙酰基转移酶(ChAT)活性明显低下,而在脑干、小脑、中央前后回和枕叶皮质其水平正常;基底前脑(如 Meynert 氏核和 Broca 氏斜角区)中的胆碱能神经元变性丢失,乙酰胆碱酯酶(AchE)活性降低。丁酰胆碱酯酶(BuChE)在正常人脑中含量很少,但在 AD 患者脑中却有明显增加。目前认为脑内 BuChE 活性增加与 AD 的进展和认知功能损害有关。此外,大量研究证实在正常人基底前脑胆碱能神经支配的靶区,如大脑皮质和海马等区域都有高浓度的 NGFmRNA 表达,可以合成 NGF,经基底前脑胆碱能神经元的轴突摄取,逆行运输至胞体,并引发神经元胞体内一些功能性蛋白和酶的表达以及神经突起的生长等一系列生物效应,对其神经元的存活和轴突的再生发挥重要作用 [12.13]。尸检证明 AD 患者基底前脑的 NGF 水平下降,而皮层和海马的 NGF 水平并未降低,说明从皮层和海马到基底前脑神经元的 NGF 运输发生障碍,而使基底前脑的神经元的神经营养作用有所欠缺,在外界损伤因素的作用下导至神经元的变性和死亡。另外,AD 患者脑内去甲肾上腺素、5- 羟色胺、多巴胺浓度均降低,脑内谷氨酸浓度升高而γ- 氨基丁酸含量显著下降,其中 Glu 是脑内重要的兴奋性神经递质, 在神经系统生长、发育、学习、记忆中起十分重要的作用。在体外添加高浓度的 Glu 或在病理条件下造成局灶周围 Glu 大量聚集均可导至神经损伤。体外实验发现 Glu 引起细胞死亡和 tau 蛋白变化, 另有实验证明 Aβ的神经毒性与 Glu 的兴奋毒性有关。神经肽中生长抑素、促肾上腺皮质激素释放激素、P 物质、神经肽 Y、阿片肽及血管加压素也有改变。
4、氧化应激和自由基损伤
氧化应激 (Oxidative Stress) 指自由基相对抗氧化防御机制过剩的一种状态,表现为自由基产物增多或抗氧化能力减退。自由基具有化学活性强,连锁反应的特点,其产生可以通过内源途径或外源途径,引起生物衰老的主要是生物代谢过程中不断产生的内源性自由基。若自由基产生过多或体内清除能力减弱,就会对机体造成伤害。由于大脑主要由易被氧化的脂质所组成,并有高耗氧率,却又缺乏高效氧化防御机制,因此对氧化损伤较为敏感。目前巳证实,随着老龄化程度的增加,大脑的氧化程度也随着加剧,老龄化是公认的 AD 风险因素。另外,正常情况下超氧化物歧化酶 (SOD) 可将超氧阴离子歧化为过氧化氢, 从而降低其浓度, 保护细胞免受自由基攻击,但在某些金属离子 (如 Fe、Cu) 大量存在下, 过氧化氢能被 SOD 转化为毒性更强的羟自由基,目前已证实 AD 患者大脑中 Fe3+ 堆积是脑内自由基来源之一, 并与 AD 的特征性神经病理改变有关[14]。此外,AD 患者超氧化物歧化酶(SOD)活性增强,脑葡萄糖 -6- 磷酸脱氢酶增多,谷氨酰胺合成酶活性减弱,脂质过氧化物酶增多,这些都会导至氧化应激增加,自由基淤积[15]。自由基损伤生物膜造成细胞内环境紊乱,导至细胞老化、死亡;损伤脂类产生过氧化,使核糖核酸失活,造成 DNA 和 RNA 交联,触发 DNA 突变。过氧化脂质分解时可产生丙烯醛等醛类,这些醛类与磷酸及蛋白结合形成脂褐素,沉积于脑导至智力障碍。同时,AD 患者脑中线粒体的损伤和氧化应激是密切相关的,有研究表明线粒体损伤和氧化应激这两种因素可相互促进,从而导至 AD[16]。
5、兴奋性氨基酸(EAAs)毒性作用
兴奋性氨基酸 (excitatory amino acids ,EAAs) 如谷氨酸和天门冬氨酸, 尤其是前者, 是哺乳动物脑内含量最高的氨基酸。Glu 是锥体细胞的神经递质,主要储存于突触前末梢内,分布集中在前脑,从新皮质到后脑含量逐渐减少。1954 年 Hayashi 首次报道谷氨酸对大脑皮层具有兴奋作用, 随后的研究又发现酸性氨基酸对脊髓神经元、海马、丘脑、大脑等结构也都产生极强的兴奋作用。哺乳动物的前脑中大约 50 % 的突触是以谷氨酸为主要神经递质。事实上, 几乎所有的神经细胞都能被谷氨酸所兴奋。这种兴奋反应是通过几种不同亚型的谷氨酸受体实现的。1969 年,Olney 首次报道谷氨酸除作为兴奋性递质参与神经元的正常信息传递外, 还具有神经毒性作用, 即过量的兴奋性氨基酸能过度兴奋中枢神经系统谷氨酸敏感神经元而达到使它们致死的程度 [17]。近年来,兴奋性氨基酸尤其是谷氨酸(Glu)的兴奋性神经毒性作用越来越受到重视。研究证实 AD 患者的新纹状体中 [3H]Glu 结合量增加,这是皮层纹状体 Glu 能神经元受损引起代偿作用的结果。Glu 参与 AD 发病的机制可能有:Glu 的快速兴奋作用,引起去极化,Cl-、Na+ 及水内流,导至细胞渗透性溶解;另外,目前的研究表明:由 EAAs 受体过度兴奋所引发的细胞内钙超载是导至神经元死亡的最终途径。因去极化激活膜电位依赖式 Glu R,使大量 Ca2+ 内流,造成细胞内 Ca2+ 超载。而神经细胞内 Ca2+ 超载可触发一系列酶促反应,激活磷酸肌醇环路,破坏细胞的超微结构,并最终导至周围大批神经细胞死亡。细胞死亡后胞内大量的谷氨酸和 Ca2+ 进入细胞间隙, 如果不能及时被其它神经元和胶质细胞摄取转运, 可进一步加重对周围神经元的伤害 [18]。
6、钙代谢平衡失调
近年来钙代谢自体平衡失调与脑老化和老年痴呆的关系已引起广泛的关注。 钙营养缺乏或吸收障碍可导至 AD。钙营养缺乏或吸收障碍导至血清钙降低,维生素 D3 合成减少,甲状旁腺激素分泌增多,使细胞内钙向外转移,细胞外钙增加易发生钙沉积,而细胞内钙减少影哉细胞的正常代谢,导至 APP 异常裂解和 NFTs 形成。细胞低钙还影响细胞的通透性、细胞间相互作用以致干扰细胞的生长发育,特别是低钙可使血清脂质过氧化(LPO)升高,自由基生成增加,使神经细胞发生变性,促进 AD 的发生、发展。另外,Ca2+ 超载会使钙依赖性生理生化反应超常运转,耗竭 ATP,产生自由基,甚至引起细胞死亡。对老化或 AD 患者的研究发现,在含有 NFT 的脑细胞和来源于 AD 患者的成纤维细胞内均到 Ca2+ 的堆积 [19]。钙超载发生在神经细胞,可引起神经可塑性及认知功能降低,出现痴呆。神经细胞内 Ca2+ 超载可触发一系列酶促反应如:(1) 激活磷脂酶 A2, 使磷脂降解, 游离脂肪酸特别是花生四烯酸增多, 后者进一步代谢为前列腺素、血栓烷、白三烯, 并有氧自由基形成, 启动膜脂质过氧化。氧自由基不仅导至神经元的非特异性损伤, 还促进兴奋性氨基酸的释放, 造成恶性循环; (2)激活蛋白激酶、核内切酶、一氧化氮合酶等, 导至神经丝降解, 微管解聚, 神经元骨架变性解体, 胞体皱缩、核固缩等;(3)突触前末梢丙酮酸脱氢酶磷酸化, 使线粒体滞留 Ca2+ 的作用降低, 神经末梢去极化, 谷氨酸释放增多;(4)突触后膜受体蛋白磷酸化, 造成膜对离子通透性失常, 加之 Ca2+ 激活中性蛋白酶, 使更多受体暴露, 增加受体对谷氨酸的亲和力, 加重谷氨酸受体活化及其偶合的 Ca2+ 通道开启所引起的 Ca2+ 超载, 最终导至周围大批神经细胞死亡。
7、基因突变
目前已发现 5 种基因的突变或多型与 AD 有关。他们或多或少涉及脑细胞内高度磷酸化的微管相关蛋白 (tau) 构成的神经纤维缠结 (neurofibrillar tanglea,NFT) 及细胞外以? 淀粉样蛋白为中心的老年斑(senile plaque,SP)等 AD 的特征性病理变化。这些 AD 相关基因包括:(1)21 号染色体的淀粉样蛋白前提 (amyloid precursor protein,APP) 基因;(2)14 号染色体的早老蛋白 (preseni- lin,PS,又称 STM)1 基因;(3)1 号染色体的早老蛋白(PS)2 基因;(4)19 号染色体的载脂蛋白 E(apol- ipoprotein E,ApoE4) 基因;(5)12 号染色体的 A2M 基因其中 PS1 与 ApoE4 基因缺陷在散发性 AD 中较为常见。这 5 种 AD 相关基因中 APP、PS1、PS2 基因与家族性早发型 AD 有关,而 ApoE 基因及 A2M 基因与家族性迟发型 AD 关系较密切,与散发性 AD 亦有一定关系。APP 基因定位于 21q21.2, 由基因经转录、翻译生成数种亚型,总称 APP。再经分泌酶水解生成 Aß,继而在胞外聚积成老年斑。目前发现 APP 基因至少有 6 种点突变,突变型 APP 可出现新的切点,易为ß分泌酶酶解,并在 y 分泌酶的配合下产生完整的 Aß,且其 Aß分泌量可高于正常 4~10 倍。早老蛋白 (PS)1 与 2 都是跨膜蛋白,可在细胞中与 APP 形成复合物,参与 APP 的转运及合成后加工,其野生型有抗凋亡作用,而突变型的早老蛋白易被半胱天冬酶(caspases) 裂解,且可使神经元中 Aß增多[20]。PS1 由 467 个氨基酸组成,其基因的定位在 14q24.3。PS1 基因突变可使ß链蛋白稳定性下降,凋亡相关基因 par-4 高表达,神经元易于凋亡;PS2 与 PS1 结构相似(67% 同源),亦由 467 个氨基酸组成,其基因定位在 1 号染色体。在家族性 AD 中已发现其 2 种误义突变(141 位 Asn→Ile;239 位 Met→Val),另据报道检出 PS2 基因缺陷的个体亦均会患有 AD。近年研究发现载脂蛋白 E 在 AD 患者脑中老年斑 (SP) 和神经元纤维缠结(NFTs)的形成中起着重要作用。ApoE 基因具有多态性,有 ApoE2、ApoE3、ApoE43 种等位基因。对 AD 患者 ApoE4 与胆碱能功能缺陷的研究表明,ChAT 活性的降低与 ApoE4 等位基因拷贝数的增加成正比。通常认为,ApoE4AD 的危险因素,而非致病因素,它是常见 AD 的主要易感基因。等位基因 ApoE4 使发病年龄提早,等位基因 ApoE2、ApoE3 使发病率降低,发病年龄延迟[21]。AD 病人的 ApoE4 等位基因出现频率远高于正常人,同时体外实验表明 ApoE4 载脂蛋白与 Aß共同保温可产生沉淀,故推测 ApoE4 可促进淀粉样斑块形成,相反 ApoE2、ApoE3 则为保护因素。A2M 基因定位于 12 号染色体,该基因编码?2 巨球蛋白,该基因异常是 AD 的危险因素 [22]。
8、内分泌失调学说
AD 发病在女性明显多于男性,有研究表明,经年龄校正后,男女 AD 发病率之比是男:女 =0.77:1.30。据调查,AD 患者血中雌酮硫酸盐浓度低于年龄相当的非 AD 者。有实验表明,雌二醇能增强大鼠认知能力 [23]。临床观察表明,雌激素替代治疗(RET)可能减少 AD 发病的危险性,同时,接受 RET 的 AD 患者其智能评分要高于未接受 RET 的 AD 患者。以上研究或观察结果均提示雌激素缺乏可能在 AD 的发病中起到一定作用。雌激素可直接促进脑内损伤神绍细胞的修复,并能通过促进星形胶质细胞发育进而支持神经元功能;另外,雌激素有促进 Ach,DA,5-HT 等神经递质的合成,增加基底前恼核团及其投射区域的乙酰胆碱转移酶活性,从而可达到改善患者情绪反应、抗抑郁焦虑、提高患者积极性等效果。同时,雌激素可能还通过改善脑部血供、直接营养神经、抑制 apoE 而促使淀粉样蛋白清楚等途径来发挥作用。
9、其他
除外上述机制外,还有诸如免疫、炎症、细胞凋亡等因素在 AD 的发病环节中发挥作用。神经炎性 SPs 中 Aß沉积可激活小胶质细胞引起炎症反应,炎症反应反过来又可增加 A? 及 APP 的产生及积聚,形成恶性的正反馈循环,导至 APP 和 Aß的量剧增 [24]。用非甾体类抗炎药能延续和防止 AD 的发作。部分 AD 患者血清中抗核抗体等自身抗体滴度增加,脑内存在主要组织相容性抗原Ⅰ型和Ⅱ型等免疫炎性标志物,而这些免役炎性物质与 AD 的病理结构(如 SPs、NFTs)密切相关。细胞凋亡是一种由基因调控的,以维持组织的自身稳定而发生的生理性的死亡过程,与中枢神经系统的衰老和 AD 的发生存在密切联系。AD 的神经元凋亡的具体机制可能与自由基及凋亡相关基因表达失调等因素有关,于脑内神经元凋亡相关的基因包括凋亡抑制基因如 bcl-2 和凋亡诱导基因如 IL-1? 转换酶(ICE)基因。另外,P53 基因与 AD 的发病也存在有一定的关系,Aß肽在神经元内沉积的过程中,P53 被激活,表达增加,诱导神经元凋亡 [25]。
遗传因素分析
双胞胎研究表明AD的患病风险60-80%来自于遗传因素,其中最常见的是APOEε4等位基因。全基因组关联研究显示,APOEε4等位基因预计增加3-4倍患病风险,但其他风险基因的作用相对较小(见图)。根据这些风险因子的存在与否计算得出的多基因风险评分,目前可以有效区分AD患者和健康人(准确度为75-85%)。
除了致病基因和风险基因,研究者还检测到了AD的保护基因。保护性APOEε2等位基因预计可以降低2倍的患病风险。此外,目前发现的具有保护作用的变异有APP的A673T突变和PLCG2的P522R突变等等。这些保护性的基因变异在AD研究中具有广阔的前景,有助于维持正常认知功能的机制研究。
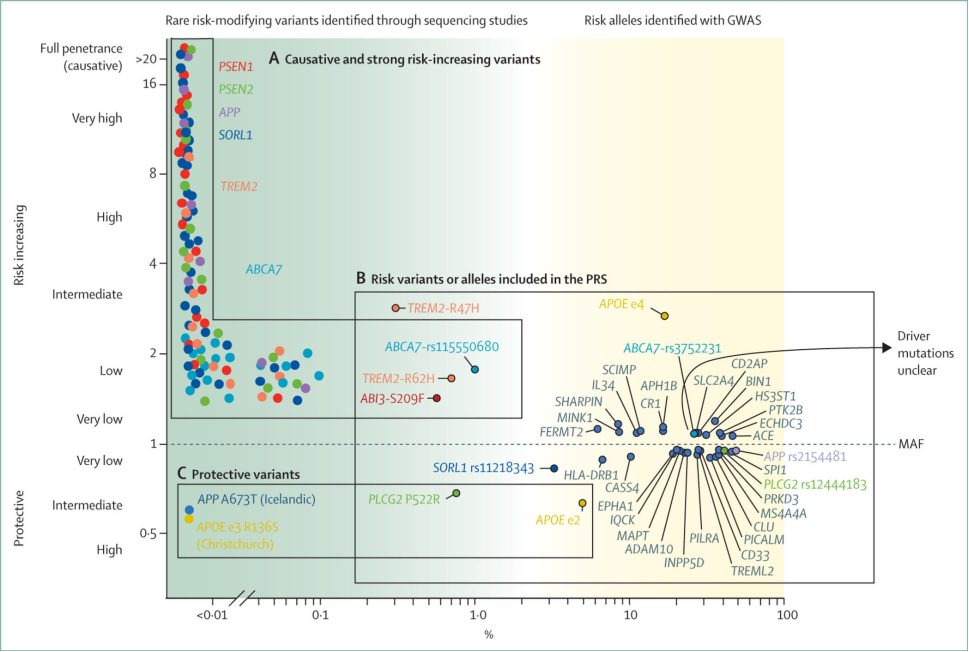
阿尔茨海默氏症的遗传景观注:横坐标表示AD患者群体中非参照等位基因出现的频率
MAF(x轴)是一个非参考(变异)等位基因在群体中出现的频率。携带OR=1的变异携带者和非携带者患阿尔茨海默病的几率相同,携带OR >1的变异与患阿尔茨海默病的风险增加相关,携带OR <1的变异与保护作用相关(y轴)。(A)的致病性或强风险增加的变异。由于极端变异罕见而无法估计的个体罕见变异的示意图。大家系的连锁研究表明,PSEN1、PSEN2和APP的特定罕见变异导至常染色体显性阿尔茨海默病,在某些情况下,发病年龄早在40岁。值得注意的是,并非这三个基因的所有变异都会导至常染色体显性阿尔茨海默病;有些可能是风险修饰因子或非致病性的。此外,越来越多的证据表明,SORL1基因中的某些变异是70岁之前阿尔茨海默病的病因。在基于基因的测试中发现了SORL1、ABCA7和TREM2基因变异的阿尔茨海默氏病关联;携带者可能来自具有阿尔茨海默病遗传模式的小家系,提示常染色体显性遗传。(B) GWAS命中是常见的(按惯例,MAF >1%)变异,代表风险等位基因,在阿尔茨海默病患者和对照组中出现显著不同的频率。每个变异都由发生变异的基因表示,或者当变异是非编码的时,由最接近变异的基因表示(用深灰色表示)。(C)保护性变异是(非常)罕见的变异,被认为对年龄相关或疾病相关的认知衰退风险因素具有抵抗力。GWAS=全基因组关联研究。MAF=次要等位基因频率。或=比值比。PRS=多基因风险评分
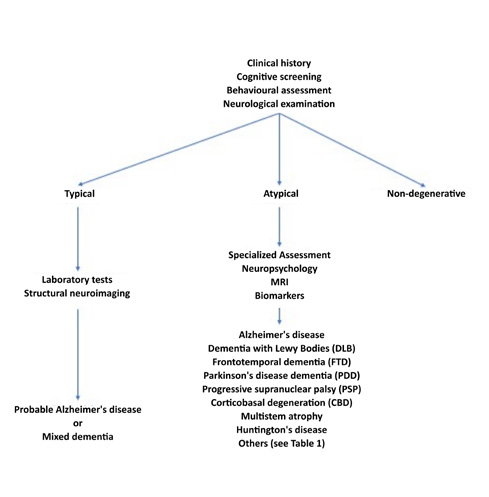
痴呆诊断流程
具有典型和非典型表现的痴呆症患者的诊断方法。(国际阿尔茨海默病报告2021)
诊断标准
国际 | 年份 |
NINDS-ADRDSA(国家神经和沟通疾病和中风-阿尔茨海默病及相关疾病协会)标准 | 1984 |
+amyloid PET | 2004 |
+Tau PET | 2004+几年 |
国际工作组(IWG) |
|
国家老年阿尔茨海默氏症协会研究所(NIA-AA) +临床前阿尔茨海默病 +轻度认知障碍 +痴呆症 | 2011 |
+标志物框架(AD research framework ) amyloid-beta, tau, and neurodegeneration (ATN) system | 2018 |
中国阿尔茨海默病痴呆诊疗指南(2020年版)的诊断标准
内容太多用思维导图进行了梳理,加好友获取脑图文件
影像
影像标志物
1.淀粉样蛋白正电子发射断层显像(Amyloid PET) 淀粉样蛋白级联瀑布学说是目前 AD 发病机制的主流学说之一。Amyloid PET 可以提供淀粉样斑块在大脑的分布和含量,与尸检结果一致率高,可作为活体显示 Aβ病理改变的最直接的诊断标志物。目前临床常用的 Amyloid PET 成像的配体主要有:11C-PIB、florbetapir、florbetaben、flutemetamol 和 AZD4694。这些配体对于皮层淀粉样变性具有较高的准确性 6。研究发现家族性 AD 患者在无症状期未出现脑萎缩和脑代谢减低时,已出现了脑内淀粉样蛋白沉积,说明 Amyloid PET 有可能是最早出现的生物标志物。然而,脑淀粉样变性是 AD 诊断的必要非充分条件。非痴呆老年人长期 Amyloid PET 随访研究显示,认知正常的老年人可出现淀粉样蛋白沉积,且随年龄增长而逐渐增加。目前 PET 由于其价格昂贵、扫描设备等问题应用仍存在一定局限性。
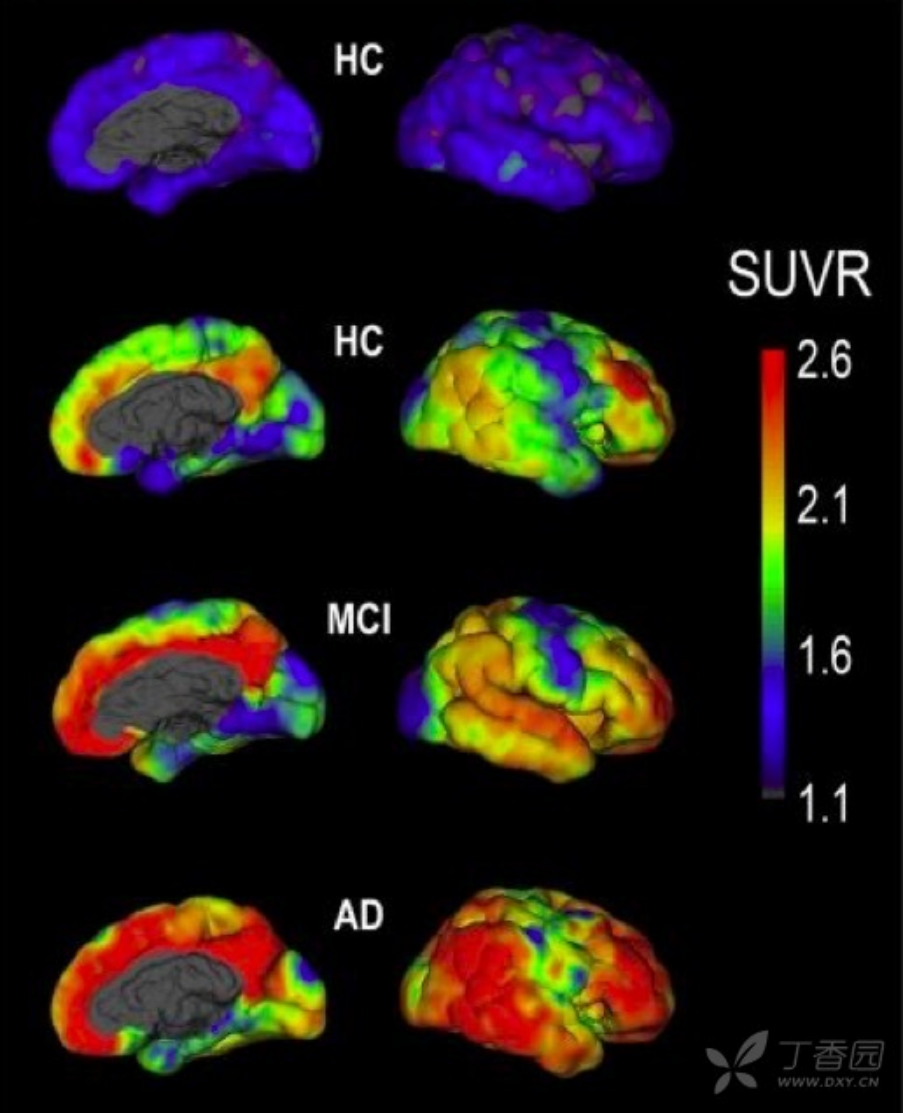
图 2 无症状健康对照组(HC)、MCI 和 AD 患者的 Amyloid PET 成像
2.葡萄糖代谢 PET(FDG PET) FDG PET 用于测量神经元和胶质细胞的葡萄糖摄取情况,被认为是突触功能变化最敏感的指标。AD 患者可出现典型的颞顶区、后扣带回皮质和楔前叶葡萄糖代谢降低,具有 90% 敏感性以识别出 AD 与其他类型痴呆。也有研究发现,AD 早期颞叶出现高代谢,提示可能为疾病早期代偿表现。携带载脂蛋白 APOEε4 等位基因认知正常受试者也被发现与 AD 相似脑区的代谢异常。因此,作为衡量脑功能改变的指标,FDG PET 对 AD 疾病进展过程中脑功能改变的评估诊断价值更高。
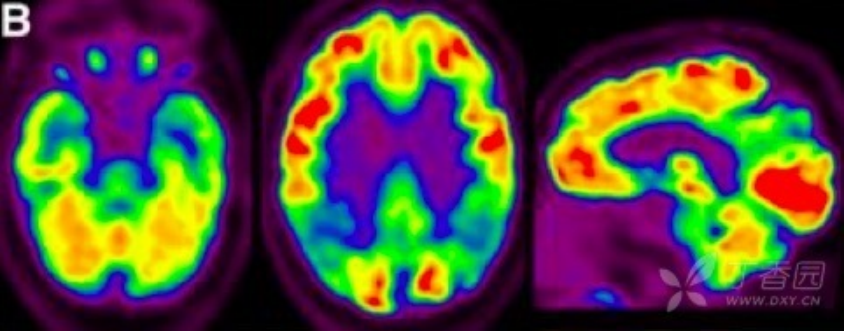
图 3 AD 患者的 18F-FDG PET 成像
3.结构磁共振(sMRI) sMRI 可测量区域性或全脑体积大小,反映因细胞损伤、轴突退变、突触失调引起的结构萎缩。最早出现并进行性加重的内侧颞叶结构萎缩可能是 AD 早期出现的特征性改变,其中海马萎缩,被认为是 MCI 进展到 AD 痴呆的最佳标志物。研究还发现,AD 早期人群的皮层灰质、内嗅皮层和海马旁回也存在萎缩。MCI 患者可出现皮质厚度变薄和全脑体积变小,可用于预测 MCI 向 AD 的转化。2011 年 NIA-AA 诊断标准将 sMRI 作为 AD 神经损伤标记物之一;然而 2014 年最新的 IWG-2 标准认为 sMRI 可能更适合用于测量和监测疾病过程。
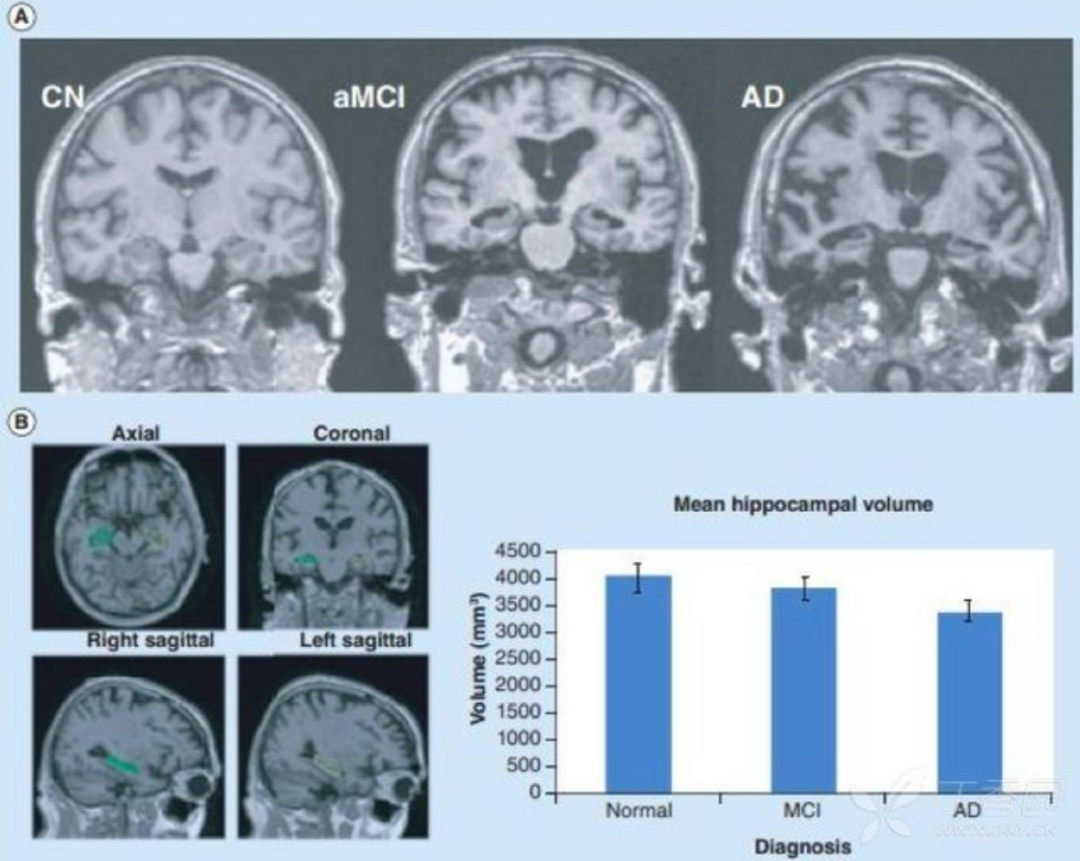
图 4 正常对照组(CN)、aMCI 和 AD 患者的海马体积结构 MRI 成像
4. 功能磁共振(fMRI) 大脑接受刺激后,神经细胞活动、局部脑血流、区域的耗氧量发生改变,fMRI 通过血流动力学反应与脑神经细胞活动之间的密切关系,可反映神经元和突触功能异常。fMRI 主要包括静息态和任务态 fMRI 两大类。研究发现,MCI 和 AD 患者存在静息网络、情节记忆网络、语义记忆网络、视空间记忆网络功能受损。脑内出现淀粉样蛋白沉积但认知功能正常的老年人、APOEε4 基因携带的认知正常老年人,也存在与记忆相关的网络连接性下降,这些研究结果提示脑功能障碍可能在 AD 早期即已出现。此外,研究还发现记忆相关网络(特别是海马)呈现非线形损害模式,即症状发生前期和轻度损害的 MCI ,影像学可首先表现为海马的高活性,随着病理的进展海马功能将逐渐减弱。多项研究已证实,AD 疾病进程中功能连接的改变早于明显的灰质体积萎缩。因此,fMRI 有可能成为诊断 AD 的早期生物标志物之一。但是 fMRI 具有血流动力学及氧代谢依赖,fMRI 成像产生的对比增强依赖于脑血流量、脑血容量和脑代谢水平 / 耗氧量,这些 fMRI 是一种间接的表现,不能直接地反映神经元活性。且目前关于 fMRI 不同研究间的结果变异较大,fMRI 用于 AD 早期诊断还需更多研究进一步验证。
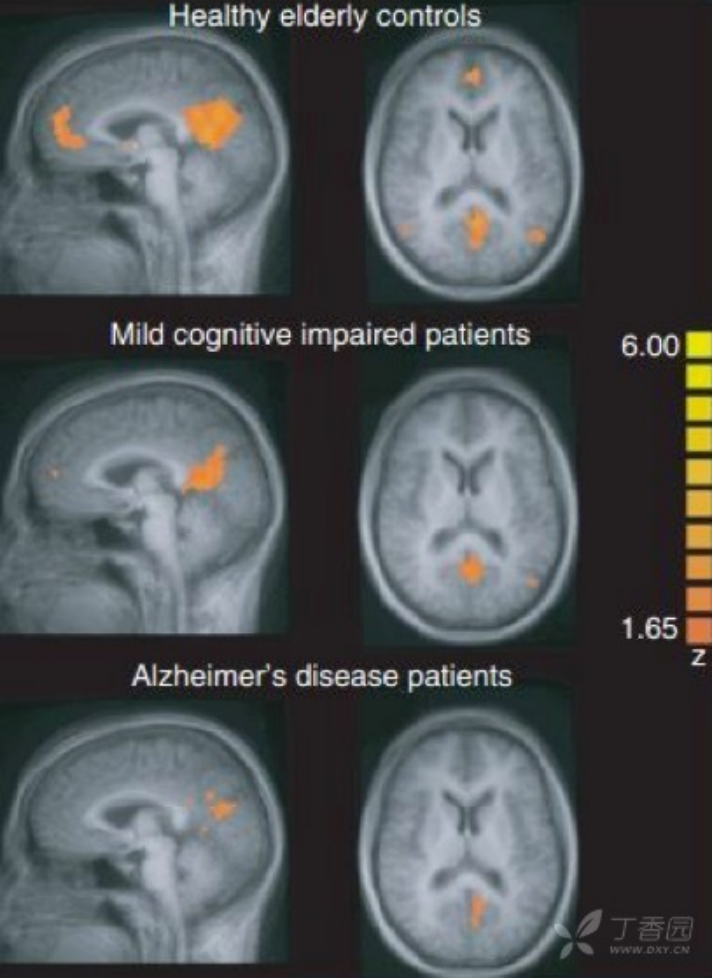
图 5 正常对照组、MCI 和 AD 患者的 fMRI 默认网络功能连接示意图
5.弥散张量成像(DTI) DTI 利用水分子的弥散各向异性进行成像,可用于脑白质纤维研究。皮层连接的结构基础为各皮层之间白质纤维束,AD 目前被认为是一种进展性的皮层失连接综合症。DTI 研究发现 MCI 存在诸多白质区域完整性破坏,如额叶、颞顶叶、下额 - 枕叶束、上纵束、胼胝体和扣带束等。与功能连接类似,AD 疾病进程中结构连接的改变早于明显的灰质体积萎缩。这些结果提示 DTI 有可能作为 AD 早期诊断的生物标志物。
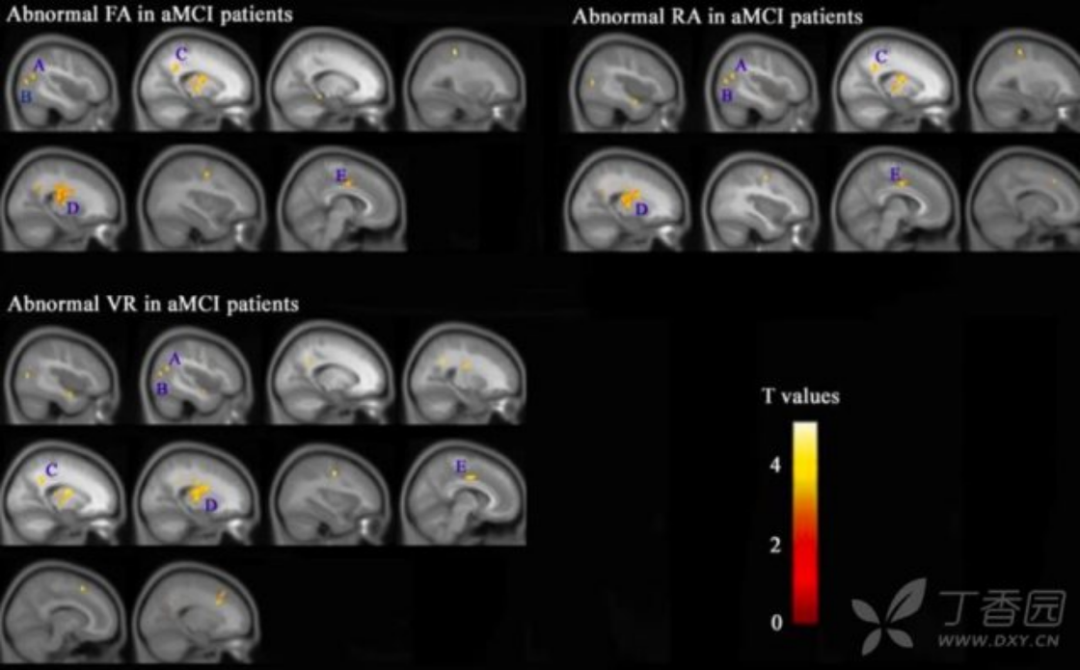
6. T2 弛豫时间成像 T2 弛豫时间是磁共振固有参数,值取决于组织本身的特点,是组织微结构完整性的间接指标,是脑内各种病理改变的综合反映。研究发现 AD 患者中,存在海马等多脑区 T2 值改变,且动物模型研究发现,在动物疾病早期斑块出现之前多脑区即出现 T2 弛豫时间值改变。AD 早期存在诸多灰白质脑区脑组织微结构完整性改变,这些微结构完整性改变明显早于体积萎缩。但这些微结构完整性改变并非 AD 特性性改变。T2 弛豫时间成像可能是 AD 早期脑组织微结构完整性的良好生物标记物。
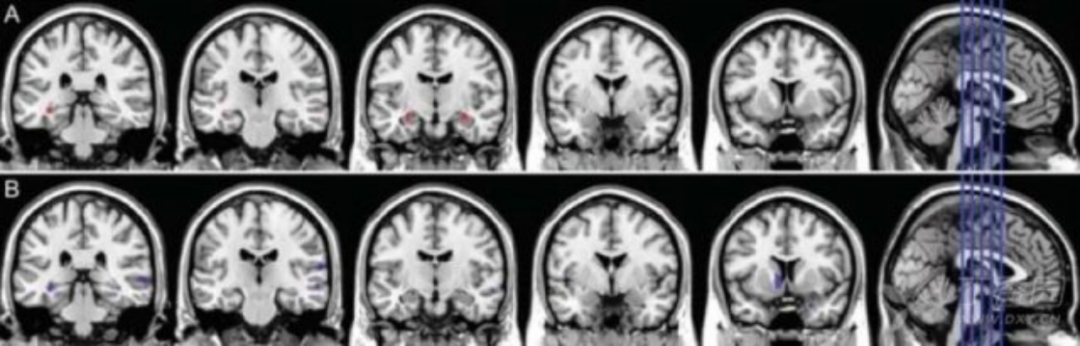
图 7 AD 患者的 T2 弛豫时间成像
7. tau 蛋白成像 利用 tau 蛋白的氟化配体进行 tau 蛋白成像目前也是研究热点。Tau 蛋白配体聚集与 AD 临床症状符合;且与 Amyloid PET 相比,与基础代谢率减退和脑萎缩更相关。目前 Tau 成像主要用于临床药物试验,对于其临床诊断价值仍需进一步证实。
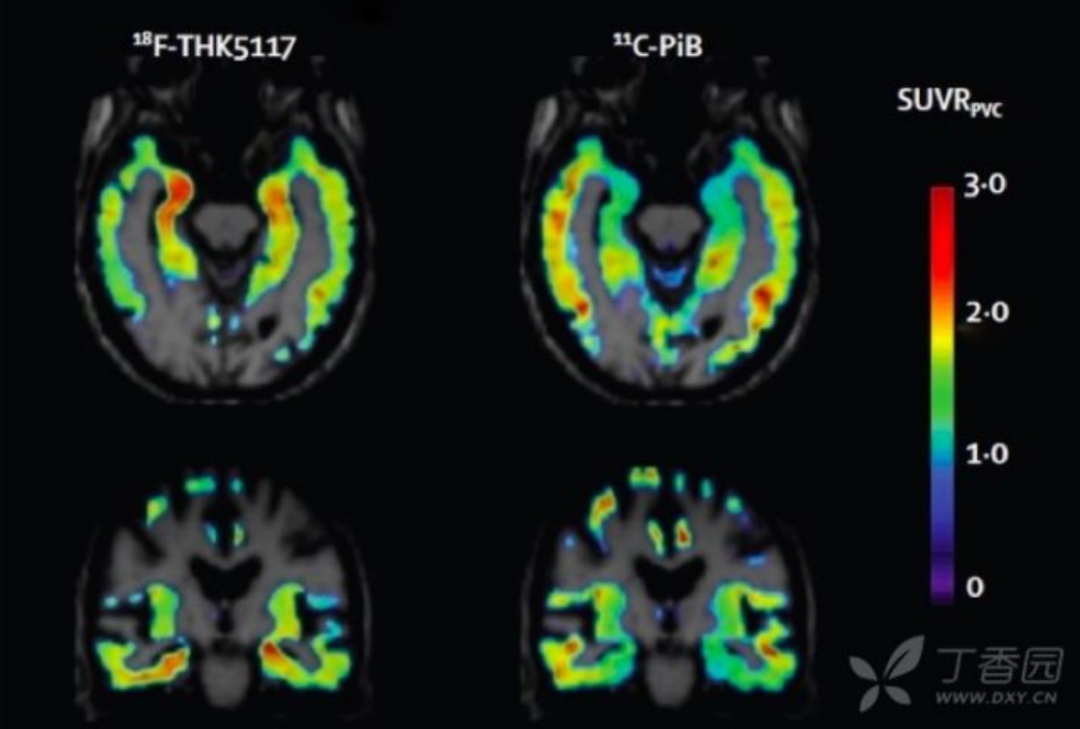
图 8 AD 患者以 18F-THK5117 和 11C-PiB 为显影剂的 tau 蛋白和 Aβ成像
8. 其他
此外,反映大脑血流量相关信息的单光子发射计算机体层扫描(SPECT)和动脉自旋标记(ASL)MRI,检测神经炎症及神经递质系统(胆碱能系统、多巴胺能系统,五羟色胺能系统组胺能系统和外周苯二氮䓬系统)改变的 PET 成像和磁共振波谱成像(MRS)等,也是 AD 早期诊断标志物的研究热点。
实验室诊断
脑脊液检测

基因检测
与神经退行性痴呆症相关的基因异常
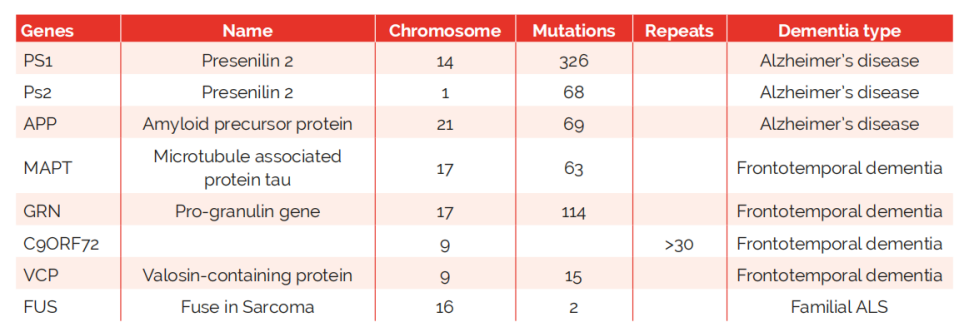
遗传因素已被确定为AD最重要的原因和危险因素之一。根据是否有家族病史,AD可分为家族性AD(FAD)和散发性AD(SAD)。大多数FAD通常表现为早发性,由早老蛋白1(PSEN1)、早老蛋白2(PSEN2)或淀粉样前体蛋白(APP)的突变引起,其中PSEN1变异在中国FAD中所占比例最大,PSEN2变异是中国晚发性FAD的原因。与APP突变患者相比,PSEN1突变患者似乎发病年龄更早,更有可能表现出语言障碍、行为障碍和计算障碍。因此,建议通过设计的基因面板、全外显子组测序或全基因组测序,对FAD家族(特别是那些具有早发或特定临床表型的家族)进行基因检测。与早发性AD相比,晚发性SAD的主要危险因素是载脂蛋白-eε4(APOE-ε4)。已经证实,携带一个APOE-ε4等位基因可使AD风险增加2-4倍,而APOE-ε4纯合子风险增加4倍。
中国额颞叶痴呆的遗传特征
额颞叶变性(FTD)是65岁以下人群伴随阿尔茨海默病出现的最常见痴呆形式之一,其特征是具有广泛的不同的临床表型。
在中国额颞叶变性人群中发现MAPT、GRN、C9orf72、CHCHD10、VCP、FUS和TBK1基因38个罕见变异。额颞叶变性的遗传性主要是由三个基因的常染色体显性突变引起的:微管相关蛋白tau(MAPT)、程序蛋白(GRN)和9号染色体开放阅读框72(C9orf72)。
|
|
| 中国发现的变异点 |
微管相关蛋白tau | MAPT | 3.9–20.9% | 11个MAPT致病变异,错义为主N279K帕金森常见、P301L认知和行为表现、G389R对应bvFTD或帕金森病患者早发性痴呆和快速进展、R5H、D177V、H299Y、V337M、N296N R5C、D54N和P513AN279K和P301L常见 |
程序蛋白 | GRN | 少 | 4个GRN致病变异,错义为主,导至PPA综合征和bvFTD |
9号染色体开放阅读框72 | C9orf72 | 重复扩增FTD-ALS中很少见 在额颞叶退行性变个体中为1.2-2.1% ALS患者中为0.8% | hexanucleotide expansions,单独导至FTD-ALS、FTD或ALS |
| CHCHD10 | 额颞叶变性病例7.7% | 8个致病变异,A21A、H22Y、P23L、P24L、A32D、V57E、P23S和P89L。单独导至SD、bvFTD、FTD-ALS和ALS |
罕见 | VCP、TBK1、FUS、ANXA11和CHCHD2 | FTD中<2% | VCP(G97E和T127A)、TBK1(I334T、R444X、E653fs和L688Rfs‘14) 、FUS、ANXA11(c.174-2A>G4、D40G、V128M、S229R、R302C和G491R)和CHCHD2 |
血清学检测标志物
Aβ蛋白、Aβ42/Aβ40、Aβ寡聚体和Aβ40、T-tau以及下表
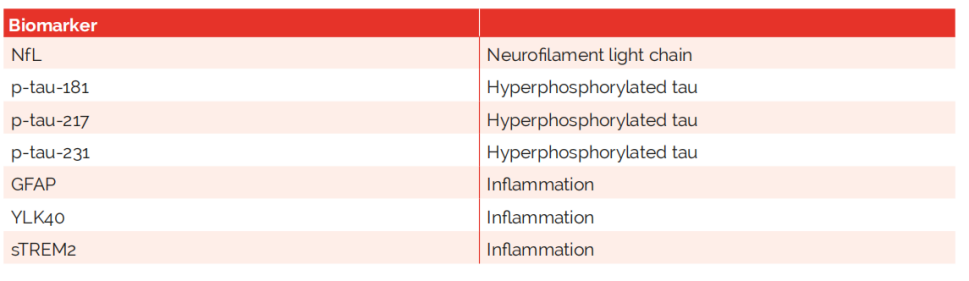
国际报告指出的常见血清标志物
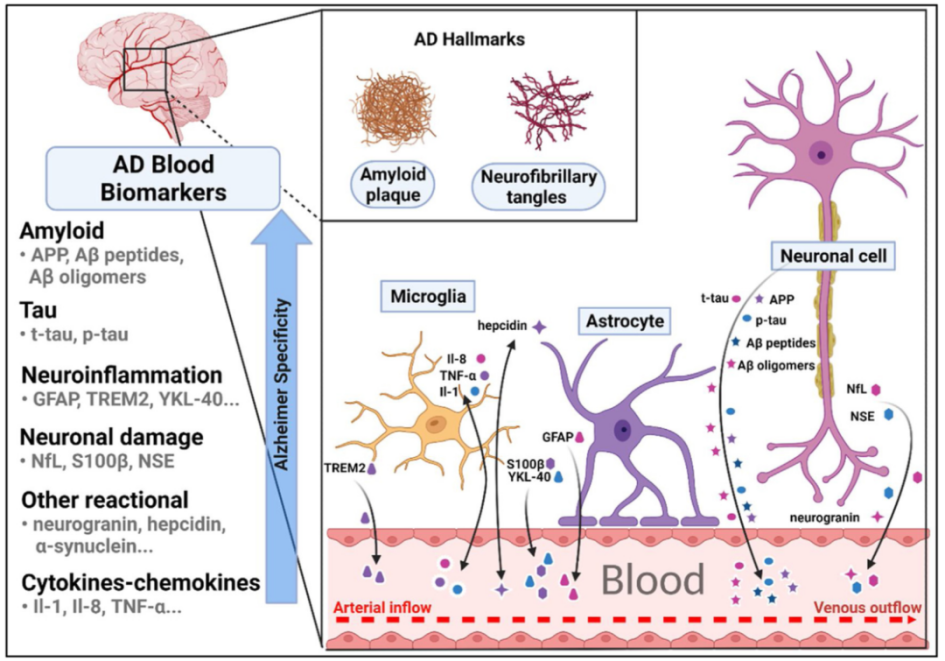
阿尔茨海默病的血液生物标志物的概述。该示意图概述了阿尔茨海默病主要血液生物标志物(淀粉样蛋白、Tau、神经炎症、神经元损伤、细胞因子/趋化因子和其他反应性生物标志物)的脑部产生及其向血液循环的转移。
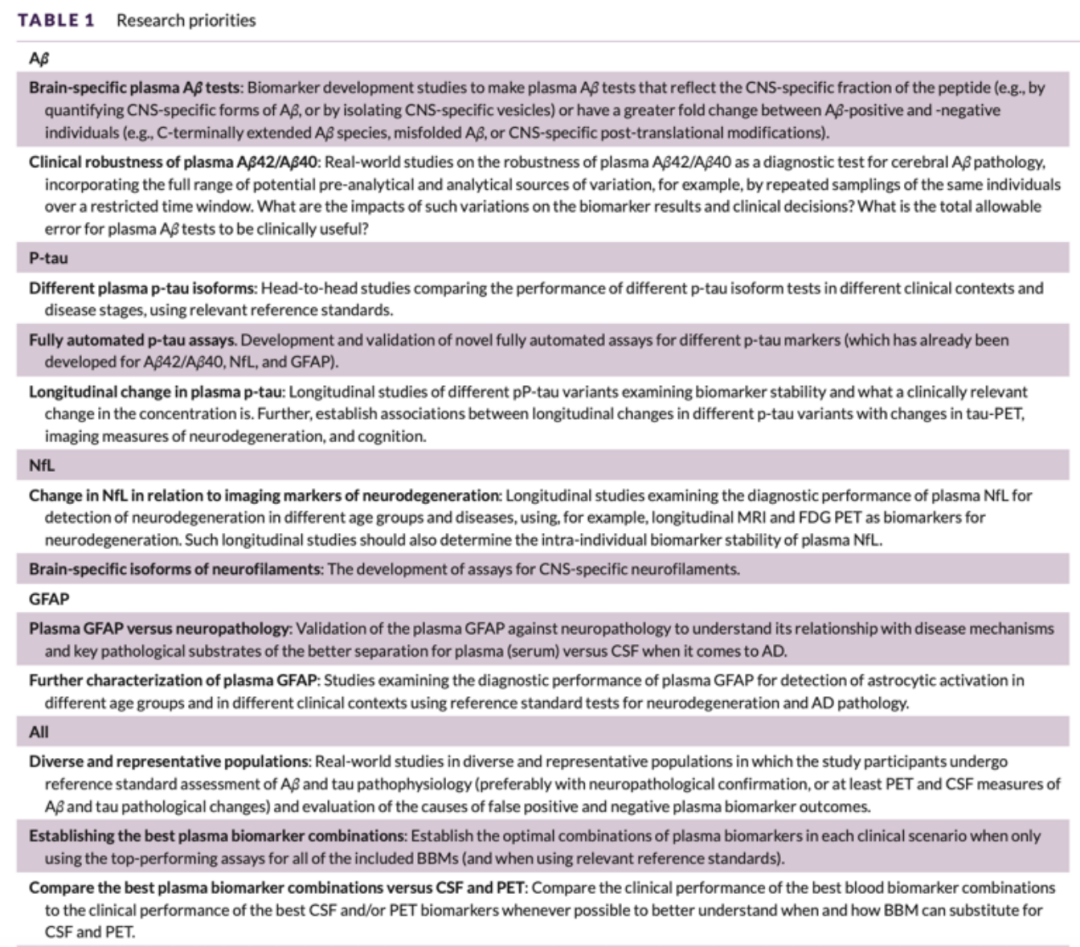
美国圣迭戈时间7月31日,2022年阿尔茨海默病协会国际会议 (Alzheimer’s Association International Conference,AAIC-2022)期间专家组在此文中详细讨论了在广泛使用BBMs Blood Based Biomarkers)之前需要进行的进一步研究。但现在已经建议使用BBMs(作为(预)筛选手段,以识别可能有AD病理变化的个体,将其纳入评估疾病修改疗法的试验中,前提是AD临床状态已被正电子发射断层扫描(PET)或脑脊液(CSF)检测证实。
与阿尔茨海默病相关的血液生物标志物包括淀粉样蛋白片段Aβ42/Aβ40比例,磷酸化Tau蛋白,与神经损伤相关的神经纤维轻链(NfL),以及与星型胶质细胞激活相关的GFAP。文章指出,这些标志物的研究目前最为深入,已经表现出与阿尔茨海默病的强相关性。研究小组建议,这些生物标志物可以作为临床试验的(初步)筛选手段,发现适合入组接受在研疗法治疗的患者,他们仍然需要PET或者脑脊液检测来确认阿尔茨海默病症状。专家小组同时建议在专科记忆诊所中使用血液检测作为已经出现认知症状的患者的诊断流程的一部分。
补充未详述的血清标志物
淀粉样蛋白标志物
Aβ寡聚体 (OAβ)
除了单体Aβ,一些研究还关注血浆的Aβ寡聚体(OAβ)的检测,最近证明它是淀粉样状态异常的一个标志,与MMSE评分和AD患者的CSF Aβ1-42呈负相关。一些研究已经描述了一些具有良好临床表现的检测方法。至于CSF中OAβ的检测,从来没有在临床常规中实施过,目前还不清楚这些检测方法是否可以超过单体Aβ的检测,并且足够强大,可以用于临床。
神经损伤标志物类
S100β和神经元特异性烯醇化酶(NSE)
S100β和神经元特异性烯醇化酶(NSE)是来自大脑的蛋白质,大多作为脑损伤的外周生化标志物进行研究。各种研究表明S100β作为AD的潜在标志物的作用,因为它的水平与AD患者的脑萎缩相关,与MMSE评分成反比,与健康人相比,AD患者血清中的S100β水平下降了。相反,在AD患者中没有观察到血清NSE水平的显著差异,但其水平在脑萎缩程度较高的AD患者中下降。此外,S100β的星形细胞过度表达已被证明是由AD中来自激活的小胶质细胞的高水平白细胞介素-1(IL-1)促进的,这表明S100β可能代表AD过程中发生的病理机制的生物标志物。然而,在血清中获得的结果应谨慎考虑,因为S100β在其他细胞类型中表达,因此观察到的变化可能只反映外周(如血管)病变。
神经炎症类标志物
胶质纤维酸性蛋白(GFAP)
胶质纤维酸性蛋白(GFAP)是成熟星形细胞的中间丝,存在于灰质和白质、小脑、脑室下和颗粒下区。GFAP也在外围由施万细胞、肠道内的成熟胶质细胞、肝星状细胞和其他非神经细胞表达。作为星形细胞激活的标志,GFAP被认为反映了神经炎症,而且血液中该蛋白的水平被描述为在临床前AD患者中较高,使GFAP成为该疾病早期阶段有希望的生物标志物候选人。此外,血浆GFAP水平被证明与临床诊断和Aβ状态有关,与对照组相比,AD患者(包括早期和晚期病理发作)的GFAP水平增加,这表明其作为一种生物标志物的作用值得关注。有趣的是,血浆GFAP在临床诊断较晚的患者中似乎较高(与较晚的患者相比),而CSF GFAP水平在整个AD连续体中没有显著差异。相应地,血浆GFAP水平和tau PET呈正相关。相反,另一项工作表明,虽然血浆GFAP可以预测β淀粉样蛋白PET的阳性,但其血浆水平与tau聚集无关(甚至在认知正常、β淀粉样蛋白状态正常的个体中)。值得注意的是,血GFAP不是AD特异性的,因为它的水平在卒中或创伤性脑损伤或额颞叶痴呆引起的急性神经元损伤后会增加。
髓系细胞触发受体2(TREM2)
许多研究表明,小胶质细胞作为中枢神经系统的免疫细胞群,在调节生理性程序性细胞死亡、清除死亡细胞(或碎片)、突触修剪或突触连接发展方面有一定的作用。小胶质细胞在衰老过程中的改变可能对疾病的发展起决定性作用,如AD。事实上,Aβ已被证明可以激活小胶质细胞,从而促进导至神经变性的炎症反应。然而,小胶质细胞也可以吞噬和降解Aβ并产生抗炎细胞因子,从而平衡炎症反应。全基因组关联研究(GWAS)之前已经确定了在小胶质细胞中表达的AD易感性遗传因素,如髓系细胞触发受体2(TREM2),它强烈增加了AD的发病风险。因此,在AD过程中TREM2信号的改变被描述为与小胶质细胞吞噬活动的异常和细胞因子产生的改变有关,这些免疫细胞转为神经退行性模式。缺少TREM2也可能导至Aβ负担增加,这是小胶质细胞反应失调的结果,它们不能聚集在Aβ斑块周围并清除它们。可溶性TREM2(sTREM2)裂解产物可在生物流体(CSF和血液)中释放,这可能构成小胶质细胞功能障碍和神经炎症的一个信息标记。与没有认知能力下降的受试者相比,AD患者的CSF中sTREM2的水平增加。此外,CSF sTREM2水平在临床前AD的过程中是动态的。因此,Aβ病理学(在没有tau沉积和神经变性的情况下)与CSF sTREM2水平的下降有关。相反,tau病理学和神经变性与CSF sTREM2水平的增加有关。血液中的结果比较矛盾,但最近的一项研究描述了AD患者血浆sTREM2浓度较低(与认知障碍者相比),血浆sTREM2水平与CSF sTREM2和CSF Aβ1-42浓度之间存在正相关。值得注意的是,sTREM2与患者年龄高度相关。此外,与认知健康的患者相比,AD和MCI患者的外周血单核细胞的TREM2表达量增加,在进展为AD的MCI患者中处于中间水平 。因此,血浆sTREM2可以作为早期外周生物标志物,用于识别神经退行性过程导至的早期认知障碍。
YKL-40
YKL-40(壳多糖酶3样蛋白1,CHI3L1)是一种炎症性标志物,最近被认为是早期MCI诊断中有用的生物标志物。这种急性期蛋白在炎症细胞因子(如TNF-α、INF-γ、IL-1β或IL-6)的作用下分泌到细胞外环境中,作为增殖、粘附、迁移和细胞分化的调节剂。YKL-40已被证明在AD患者的大脑(Aβ斑块周围的团块)和CSF中增加,也在各种临床背景下的患者血清中增加,如血管性痴呆或混合性痴呆。此外,相应地,MCI患者血清中的YKL-40显著增加(与CSF中该标志物的水平相关),其数值随着疾病的进展(和转化为AD)而增加,从而提示该生物标志物在诊断MCI和转化为轻度AD方面的潜在作用。血清YKL-40被证明与认知能力下降的程度(用MMSE量表测量)和t-tau的浓度相关。有趣的是,CHI3L1基因的多态性被描述为与AD的风险和预后有关,并可能影响血浆中YKL-40的表达。然而,YKL-40对AD-痴呆症没有特异性,将其与其他标记物(如Aβ1-42、t-tau和p-tau)结合起来,可以提高其诊断性能。
细胞因子和趋化因子
AD发病机制的一个关键事件是神经炎症过程,其特点是小胶质细胞的激活和促炎症细胞因子的增加。这种神经炎症似乎有复杂的影响,可能是有益的(通过促进Aβ的清除),也可能是有害的(通过胶质细胞激活和促炎症细胞因子的产生,对神经元有害和有毒)。MCI或AD患者血清中细胞因子、趋化因子和生长因子水平的差异已被描述,各种生物标志物已被提议作为血液特征的一部分(其中一些随后被AD神经影像学倡议,ADNI证实)。特别是肿瘤坏死因子-α(TNFα)在脑神经病理学中的作用被广泛描述,这种促炎症细胞因子在AD患者的血浆和CSF中增加。我们最近证实了这种细胞因子作为AD血液生物标志物的意义,并描述了在AD患者的不同随访时间(基线、12和24个月),TNF-R1和NfL之间有很强的关联性。我们还显示,在这些患者的基线和24个月的随访中,NfL和TNFα之间存在相关性,这可能突出了TNF/TNF受体途径对AD患者预后或治疗应用的潜在作用。白细胞介素1β(IL-1β)也被描述为促进淀粉样斑块的形成和神经纤维缠结在AD患者大脑中的积累。吸附性趋化因子--如IL-8、CCL4(MIP-1β)、CCL2(MCP-1)或CCL3(MIP-1α)--也被描述为通过调节小胶质细胞迁移到炎症部位而参与AD的炎症过程。
为了建立这种血液中的炎症特征作为AD的诊断工具,已经发表了许多文章。然而,由于异质性和所使用的队列规模不同,也由于所使用的样本的性质(血清与血浆),或用于量化生物标志物的技术的相对敏感性,不同研究的结果一致性很差,对这些工作进行严格的比较仍然具有挑战性。因此,到目前为止,这些血浆特征的诊断用途仍然有限。
其他反应性标志物
神经颗粒蛋白
神经颗粒蛋白是一种突触蛋白,据描述,与认知障碍者相比,AD患者的CSF增加,而MCI患者没有显著增加。因此,在有前驱性症状的AD病例中,CSF神经颗粒蛋白的水平也很高(随着认知能力下降的进展,其数量也在增加)。神经颗粒蛋白在释放到CSF之前可以被裂解成一系列的C端肽,全长和裂解/全长肽在AD患者的CSF中都会减少。人类血浆中也有几种内源性的神经颗粒蛋白,但与对照组相比,没有一种被描述为在AD患者中增加。相反,在AD和MCI患者中观察到血浆外泌体中的神经颗粒蛋白水平下降,其数量与受试者的认知能力下降高度相关。因此,可以考虑将神经颗粒蛋白血液外泌体作为AD和MCI的认知生物标志物的效用,但更多的是出于调查的目的,因为这种评估的分析很复杂。
a-Synuclein
许多研究表明,突触前蛋白a-synuclein,aSyn(最好描述为与帕金森病或DLB等突触蛋白病有关)参与了AD的病理生理学。对AD患者(家族性和散发性AD)的死后检查发现了aSyn在尸检大脑中的积累。此外,在MCI和AD患者中,CSF aSyn的水平较高(与认知障碍者相比),与认知能力下降呈正相关。很少有研究测量AD患者血液中的aSyn,与健康人相比没有显著的差异。然而,较高的血浆Aβ1-42和aSyn水平最近被描述为可能具有中到高的鉴别能力,以识别失忆性MCI患者的认知功能障碍。
铁调素(hepcidin)
越来越多的证据表明,在AD的发病机制中,大脑铁的平衡被破坏,因为不同的铁复合物在与AD等运动和认知障碍相关的脑区逐渐积累。健康成人大脑中总铁的区域分布是异质性的,其随年龄的变化可以通过成像方法(如磁共振成像)在体内确认。除了其大脑空间分布外,分子形式(如铁蛋白、血红蛋白)以及金属在神经元和胶质细胞之间的分布也会随着正常衰老而改变。随着年龄的增长,大脑铁的积累可能是由几个因素造成的,包括血脑屏障通透性的增加、炎症、铁在大脑内的重新分布以及铁平衡的变化。肝素是一种铁代谢的调节激素,其作用是通过结合和内化唯一的铁输出体,即膜铁转运蛋白来限制细胞的铁释放。这导至了细胞内铁的保留和逐渐积累。与年龄匹配的健康人相比,AD患者脑组织中的肝素水平下降。相反,在血液中,AD患者的hepcidin水平显著高于对照组。此外,有报道称血液中的hepcidin水平也与AD的严重程度呈正相关,测量血清中hepcidin水平与认知功能丧失的早期表现可能有助于AD的诊断和疾病严重程度的评估,特别是与血浆Aβ1-42/Aβ1-40比率相结合时。循环铁和炎症(特别是通过IL6)都可以正向调节hepcidin的表达。因此,AD患者的神经炎症也可能导至hepcidin水平的增加,因此参与了大脑中铁的逐渐积累。
Transcriptional biomarkers
AD与遗传成分密切相关。大规模的GWASs已经确定了20多个AD风险位点,众多风险性状相关的单核苷酸多态性(SNPs),可能通过控制附近基因的表达来促进疾病的发病机制,但也有转录风险评分(TRSs),以及功能基因的极化表达水平的汇总,也可能反映AD的风险。最近一项基于ADNI和AddNeuroMed队列的转录组数据库的研究表明,基于血液的TRS与AD生物标志物显著相关,为这些生物标志物在AD诊断中的作用打开了有趣的视角。在MCI和痴呆阶段,对AD基因表达的研究也被引导到调查基于mRNA表达或血液miRNAs的诊断和预后生物标志物的潜力。甚至有人提出了一个基于血液的转录组角度来诊断AD,但其实际效用和稳健性还有待验证。
新陈代谢相关标志物
载脂蛋白
载脂蛋白E(apoE)是大脑中主要的脂质转运体,也是AD的最佳风险因素,因为这种载体的异构体对淀粉样蛋白β的聚集和清除有不同的影响。作为大脑中神经元活动和损伤修复所需的胆固醇的主要载体,apoE4确实可能导至突触缺陷和长期增效、记忆和认知的损害。apoE促进淀粉样蛋白β降解的能力也取决于其脂化状态:在这种情况下,ABCA1(ATP结合盒转运蛋白,负责将胆固醇转运到包括apoE在内的载脂蛋白上)可能在通过Aβ降解酶促进Aβ清除方面起关键作用。一致的是,小鼠ABCA1的缺乏导至中枢神经系统中的apoE脂化不良,从而促进了AD小鼠淀粉样蛋白沉积的形成,而它的选择性过表达则增加了apoE的脂质化,并防止淀粉样蛋白斑块的形成。在人类中,常见和罕见的ABCA1基因变体也与AD的风险有关。此外,apoE的构象和脂化状态也可以影响其与受体(LRP1)的结合,从而影响Aβ在体内的沉积。此外,LRP1是肝脏中Aβ的主要受体,它在外周组织(肝脏中)的存在可能影响Aβ5在大脑中的代谢。不同的研究表明,clusterin(又名apoJ)也可能发挥Aβ的伴侣作用,调节其清除和沉积,与apoE的作用相似。
血管紧张素转换酶(ACE)负责转换血管紧张素(I到II),随后导至脑血管收缩和损伤,促使AD的风险增加。有趣的是,最近一项研究调查了ACE1和九个apo蛋白(apoAI、apoAII、apoAIV、apoB、apoCI、apoCIII、apoD、apoE和apoH)作为血液生物标志物的水平,显示了这些候选物对AD诊断的潜在效果。
神经营养因子
神经营养因子(NTFs)是经典的生长因子,分为四个主要家族:神经营养素、神经因子、胶质细胞系NTF家族配体和脑多巴胺/胃细胞衍生的NTF家族。NTFs能够防止细胞死亡,并能增加神经退行性疾病的神经元生长和功能。
脑源性NTF(BDNF)是一种神经营养素,通过促进神经发生和突触生长,参与神经元的生存、功能和发育、认知和记忆。BDNF在大脑中广泛表达,特别是在大脑皮层、海马体,并以双向方式穿过血脑屏障,使其在血液中得到检测。因此,较高的血清BDNF水平被认为对痴呆症和AD的发生起到了预防作用。
胶质细胞系NTF(GDNF)因其能够促进中脑多巴胺能神经元内的多巴胺摄取而首次被发现。GDNF与其受体结合后会触发若干细胞内信号通路,参与神经元-神经元和神经元-目标组织相互作用的发展、生存和维持。与年龄匹配的对照组相比,AD患者血清中的GDNF水平显著下降,这表明GDNF作为AD的血液生物标志物具有潜在作用。
肠道和肥胖症标志物
肠道上皮细胞损伤(和随后的微生物异位)被描述为参与AD发病机制中的神经炎症,可能主要是作为风险因素。这些改变的不同标志物可以在血液中进行监测,如人类回肠胆汁酸结合蛋白(I-BABP)、肠道脂肪酸结合蛋白(I-FABP)和脂多糖结合蛋白(LBP)。
脂肪酸结合蛋白(FABPs)在细胞内充当脂肪酸和其他疏水性配体的细胞内伴侣。脑型FABP(B-FABP)的血清水平被描述为在包括AD在内的各种神经退行性疾病患者中占有相当大的比例,这表明这种生物标志物可能允许对这些患者进行分层。
肥胖被广泛描述为与AD相关的风险,尽管它影响认知分数的确切机制仍不清楚。脂联素是血液循环中最丰富的脂肪因子,与脂肪组织功能障碍成反比,似乎是这种关联的一个关键角色。因此,脂联素会影响(直接和/或间接)β淀粉样蛋白和tau聚集物的形成。
糖尿病和血糖标志物
糖尿病(DM)是一种以高血糖为典型特征的慢性代谢性疾病。流行病学数据描述了与健康人相比,糖尿病与患痴呆症的风险增加之间存在关联。事实上,大脑是一个对胰岛素敏感的器官,越来越多的证据表明这种激素控制着参与记忆形成的几种神经递质的浓度,如乙酰胆碱、肾上腺素和去甲肾上腺素。胰岛素还能促进神经元的可塑性,大脑中胰岛素信号的改变会大大影响认知和神经功能,导至MCI和AD。
有趣的是,携带APOE4等位基因的个体在后扣带回、楔形前和/或侧顶区的葡萄糖代谢较低。因此,大脑中葡萄糖含量异常的糖尿病患者患AD的风险增加,最近的一项研究因此描述了HbA1c水平与AD之间的关系。
基于血液的生物标志物在临床试验中的潜在的未来用途
生物标志物在阿尔茨海默病(AD)临床试验中的应用对筛选、纳入和治疗结果都有帮助。针对筛选和纳入,临床试验取决于正确的受试者分组,以获得正确的治疗,因此可以使用各种生物标志物作为大众人群筛选和纳入标准。受试者的分类可以使用风险/易感性生物标志物(表明发病的可能性)、诊断性生物标志物(检测或确认疾病的存在)、分层标志物(如年龄或遗传风险因素,如脂蛋白Eε4,对于哪些阶层预计对治疗有更强的反应),以及预测性生物标志物(确定谁可能从特定的治疗中获益并对其有反应)。针对治疗结果,一旦临床试验开始,可以通过测量药物对目标蛋白的影响以及生物标志物作为临床试验的终点来监测受试者的反应和结果;最终是希望使用生物标志物作为预测临床终点的代用终点。

02
基于血液的生物标志物在初级保健中的潜在的未来应用
在初级保健中,我们需要简单而准确的方法,以便能够在有认知问题的病人中识别不同的潜在神经退行性疾病。理想情况下,基于血液的生物标志物和临床评估可用于确定患者患有神经退行性疾病(如阿尔茨海默病(AD))的概率,这将改善患者管理,包括关于治疗或转诊到专门诊所的决定。然而,非常重要的是,新的诊断算法(基于血液中的生物标志物)在临床实践中实施之前,要根据相关的参考标准在大型和多样化的初级保健人群中进行前瞻性验证。
神经退行性疾病的特征cell综述
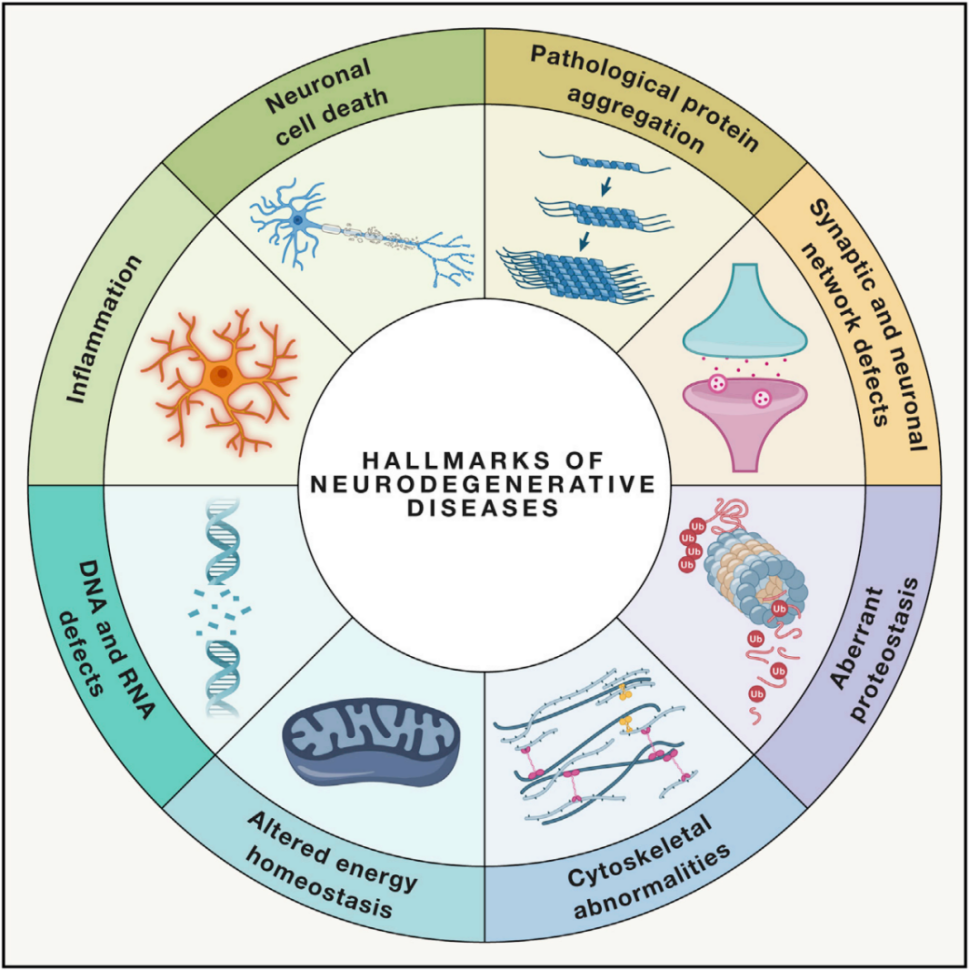
该方案识别并说明了本文中描述的八个特征。基于几十年的基础、翻译和临床研究,遗传因素和生化途径下许多NDDs被确定,导至识别八NDDs的特点:病理蛋白质的聚集,突触和神经网络功能障碍,异常蛋白酶,细胞骨架异常,改变能量稳态,DNA和RNA缺陷,炎症和神经元细胞死亡。综述详述了八大特点,看一篇就够了。
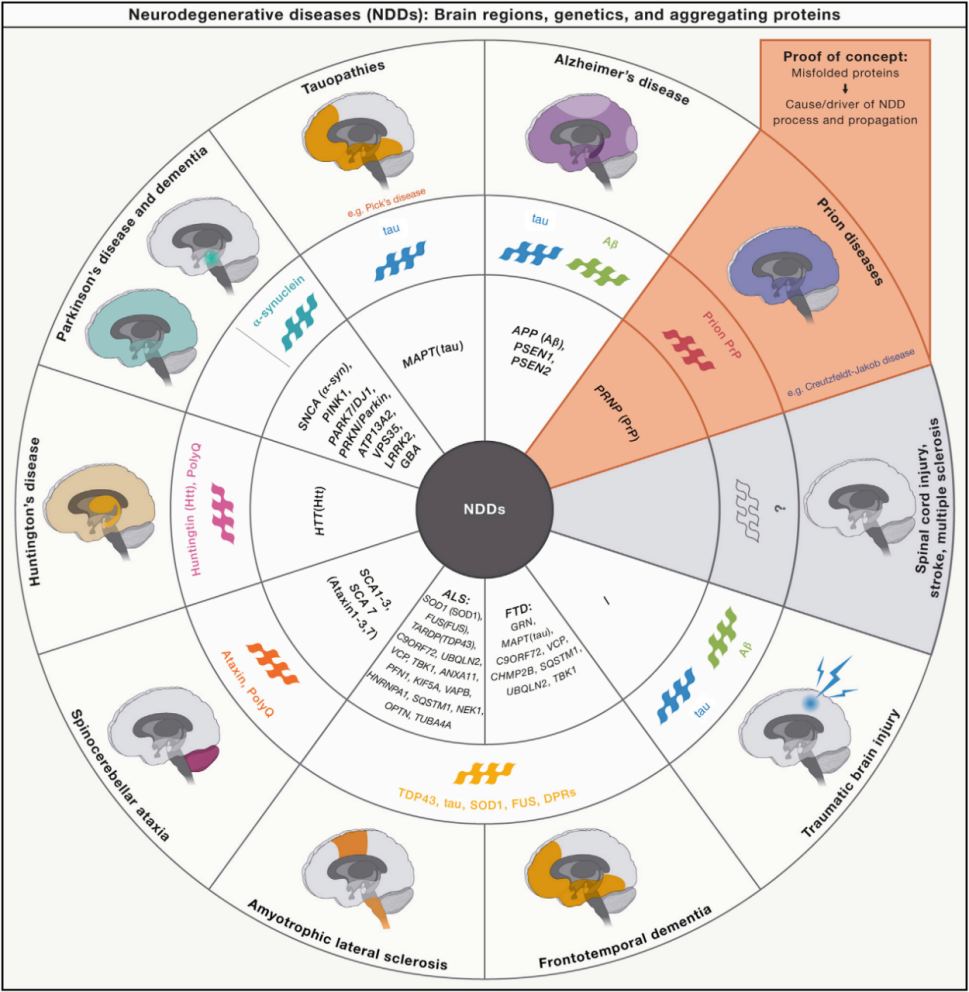
特征聚集蛋白,与脑区相关和影响脑区的基因
外环分别显示了ndd和受影响的脑区。它们各自的症状、受影响的大脑区域、相关基因和聚集蛋白以前已经被详细描述过。NDDs的特征聚集蛋白包括淀粉样前体蛋白(APP)(APP基因)、tau蛋白(MAPT基因)、共核蛋白(SNCA基因)、焦油dna结合蛋白43(TDP-43)(TARDBP基因)、超氧化物歧化酶(SOD1)(SOD1基因)、二肽重复蛋白(DPRs)(C9orf72基因)、FUSrna结合蛋白(FUS基因)、杭丁顿蛋白(PolyQ)(HTT基因)、多q蛋白(PolyQ)和细胞朊蛋白(PrPC)(PRNP基因)形成的Aß肽。与不同NDDs相关的因果基因和最高风险基因的非详尽列表。
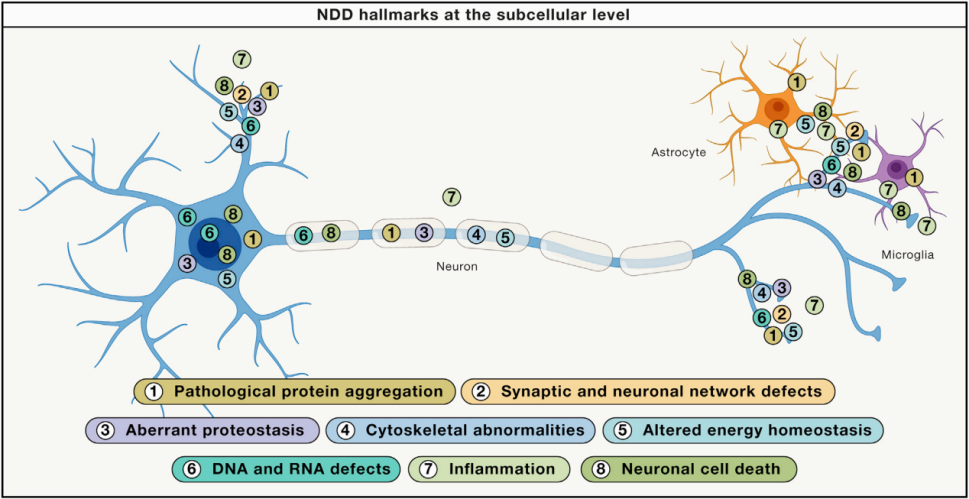
NDD特征及其位置的示意图
示意图不同NDD标志(编号)和他们的位置在模型神经元和/或神经胶质细胞提出病理蛋白质聚集(1),突触和神经元网络功能障碍(2),异常蛋白酶稳态(3),细胞骨架异常(4),改变能量稳态(5),DNA和RNA缺陷(6),炎症(7)和神经元细胞死亡(8)。

NDDs的标志及其相互联系作为一个框架分类NDDs和识别子型在NDDs,作为个性化的基础,组合和多目标治疗有效阻止NDDs (A)特点的相互联系示意图,提供一个框架研究NDDs的整体方法。该框架支持根据其主要特征对nDD进行分类,例如常见的nDD,即AD、PD、ALS、FTD和HD。(B)此外,该框架能够识别特定ndd中的患者亚型,从而根据其主要特征(B).对患者进行分层这些是由NDD侮辱,以及个体的神经元弹性和脆弱性。所示是AD中子类型的例子。因此,NDD治疗策略可以根据个体特征进行设计,从而设计个性化、多靶向治疗。
治疗
可治疗的痴呆(机翻)

(1)早诊早治,终身管理。
(2)现有抗AD治疗药物虽然不能逆转,但可以阻断或者延缓疾病进程,应该尽早尽可能长期治疗。如果能够在临床前期阻断病程,就有可能将阿尔茨海默病从不治之症转变为像糖尿病或者高血压一样的可防可控的慢性病,终生维持在临床前期不进展,保留患者的生活质量和尊严,减轻照料者的负担。
(3)针对痴呆伴发精神行为症状(Behavioural and Psychological Symptoms of Dementia,BPSD)妄想、幻觉(幻听、幻视)、抑郁、淡漠、焦虑、脱抑制等思维、情绪、行为障碍的治疗:痴呆老人最典型的精神行为症状就是妄想,比如被窃妄想:东西找不到就怀疑有人偷走了,而被“偷”的东西往往不是什么重要的,只是一些琐碎生活用品;被害妄想:总是担心周围的人要害自己,到了晚上就夸张地把门窗堵上;或者怀疑家人要害自己而拒绝吃药,甚至拒绝吃家里人做的饭,只喝矿泉水、牛奶等密封包装的食品,或者跟着做饭的人的筷子夹菜,怕自觉这边的菜会被下毒等等症状。还有些精神行为异常症状:患者总是认为自己的老伴与他人有不正当关系,这也是妄想的表现。对于BPSD的治疗要在抗痴呆治疗基础上,首选非药物干预,必要时选用非典型抗精神病药物,切记定期评估疗效和副作用,小剂量滴定,见好就收。
(4)对照料者的健康教育和心理支持等很重要,可改善AD患者和家属的生活质量,不容小觑。
药物及进展
类别 | 类型 | 品名 | 作用及要求 |
改善认知的药物或益智药 | 作用于神经递质的药物胆碱酯酶抑制剂 | 多奈哌齐(商品名:安理申) | 通过竞争性抑制乙酰胆碱酯酶,提高神经元突触间隙乙酰胆碱递质的浓度 |
| 卡巴拉汀(商品名:艾斯能胶囊) | 同时抑制乙酰胆碱酯酶和丁酰胆碱酯酶 |
脑代谢赋活药物 |
| 扩张脑血管,增加脑皮质细胞对氧、葡萄糖、氨基酸和磷脂的利用,促进脑细胞的恢复,改善功能脑细胞,从而达到提高记忆力目的 |
谷氨酸受体拮抗剂 | 盐酸美金刚(商品名:易倍申) | 为具有中等亲和力的非竞争性N-甲基-D-天冬氨酸拮抗剂。可以降低过量的谷氨酸递质对神经细胞的毒性。 |
针对精神行为症状的药物治疗 | 抗精神病药 | 利培酮、奥氮平、喹硫平 |
|
抗抑郁药 | 5-羟色胺再摄取抑制剂(SSRI)帕罗西汀(赛乐特)、氟西汀(优克,百优解)舍曲林、曲唑酮、西酞普兰、米氮平 |
|
心境稳定剂 | 丙戊酸钠 |
|
抗焦虑药 | 阿普唑仑、奥沙西泮(去甲羟安定)、劳拉西泮(罗拉)和**(**) |
|
单抗药 |
| Aducanumab,Lecanemab | MMSE评分要在21-28分之间,,使用前需要检查淀粉样蛋白,阳性者才可以用 |
其他 | 甘露特钠 | GV-971 | 2019 年11 月2 日,国家药品监督管理局有条件批准了甘露特钠胶囊用于治疗轻中度AD。重塑肠道菌群平衡药物,能降低外周相关氨基酸代谢产物、减轻脑神经炎症,改善认知功能,可用于轻、中度阿尔茨海默病的治疗 |
中药(既然上指南了凑合看) | 银杏叶提取物EGb761 |
| 对早中期AD痴呆认知、行为和功能有轻微疗效 |
| 清宫寿桃丸 |
| 对前驱期AD认知有益( |
| 补肾法、化痰法、活血法、泻火法、解毒固脱法 |
| 序贯疗法加常规西药对AD痴呆认知和行为有协同效益 |
治疗药物临床情况
通过整理在ClinicalTrials进行的研究情况,发现在中国有97项已经完成或者正在进行的临床试验,其中41项是于2019年注册的(见图4和图5)。抗Aβ疗法、神经调节疗法、干细胞疗法和中医药是过去2年临床应用的主要方法。

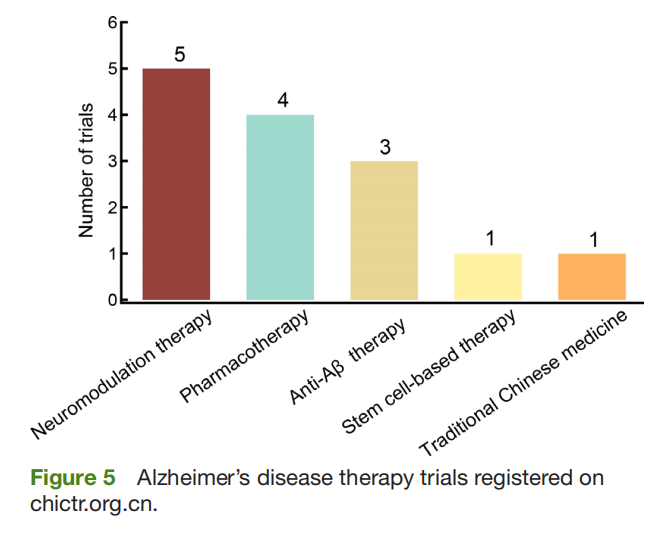
中国AD治疗效果
阿尔茨海默病全程支持管理的关键是定期随访与复诊,然而调查显示,将近 1/4的受访者(24.39%)表示从未去过医院参加复诊,半年内复诊的受访者比例不到四成(39.01%)。公众对阿尔茨海默病需终身用药认可度较高(77.04%),91.36%感受到治疗获益,30.32%表示用药后病情基本稳定。

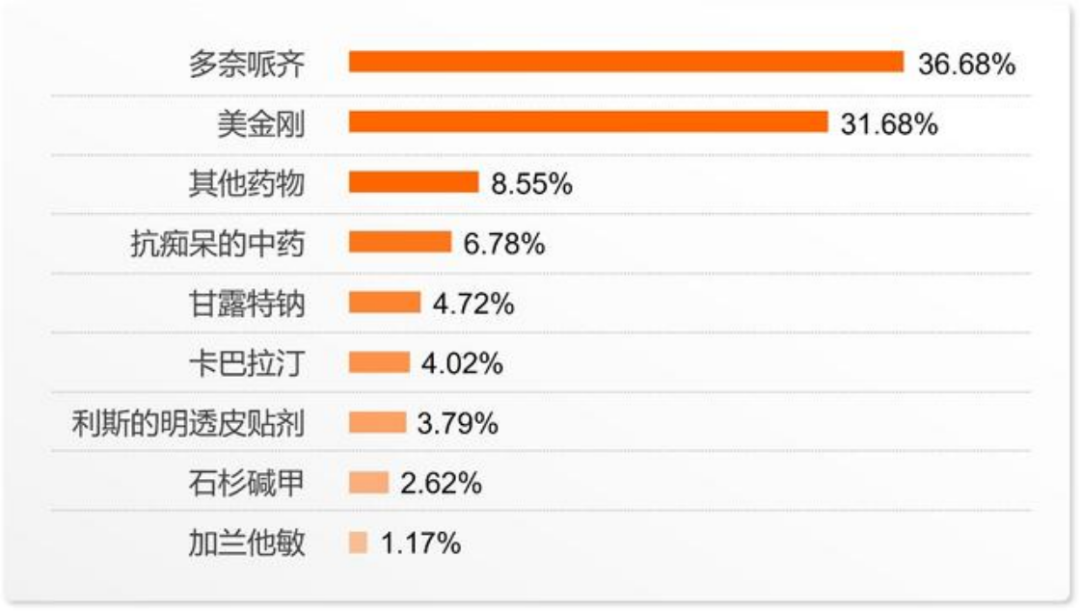
正在服药的城市患者中,有70.29%服药时间在1年以上;在农村,有66.67%的受访患者服药时间不足1年。使用的抗痴呆药物比例最高的是多奈哌齐(36.68%),其次是美金刚(31.68%)。
参考文献
阿尔茨海默病的诊断与鉴别诊断
阿尔茨海默病治疗大全 韩璎教授
《前驱期阿尔茨海默病的简易筛查中国专家共识(2023年版)》中华医学会神经病学分会痴采与认知障碍学组中国医师协会神经内科医师分会认知障碍疾病专业委员会
《阿尔茨海默病源性轻度认知障碍诊疗中国专家共识2021》中华医学会神经病学分会痴呆与认知障碍学组
《2022中国阿尔茨海默病与相关认知障碍公众防治知识调研报告》
RenR, Qi J, Lin S, et al The China Alzheimer Report 2022 General Psychiatry 2022;35:e100751. doi: 10.1136/gpsych-2022-100751
Wilson DM 3rd, Cookson MR, Van Den Bosch L, Zetterberg H, Holtzman DM, Dewachter I. Hallmarks of neurodegenerative diseases. Cell. 2023 Feb 16;186(4):693-714. doi: 10.1016/j.cell.2022.12.032. PMID: 36803602.
BiG生物创新社 Cell 综述丨神经退行性疾病的八大生物标志
Hansson O, Edelmayer RM, Boxer AL, et al. The Alzheimer’s Association appropriate use recommendations for blood biomarkers in Alzheimer’s disease. Alzheimer’s Dement. 2022;1-18. https://doi.org/10.1002/alz.12756
IVD原料世界公众号 权威发布:阿尔茨海默病的血液生物标志物!
Proteinnews公众号【神经类】丨阿尔茨海默病的血液生物标志物概述:承诺和挑战
丁香叶公众号,阿尔茨海默病概
Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, Cummings J, van der Flier WM. Alzheimer's disease. Lancet. 2021 Apr 24;397(10284):1577-1590. doi: 10.1016/S0140-6736(20)32205-4. Epub 2021 Mar 2. PMID: 33667416; PMCID: PMC8354300.
丁香园:Alzheimer 病发病机制研究进展,山东省立医院神经内科,闫鹏 杜怡峰
 /3
/3 