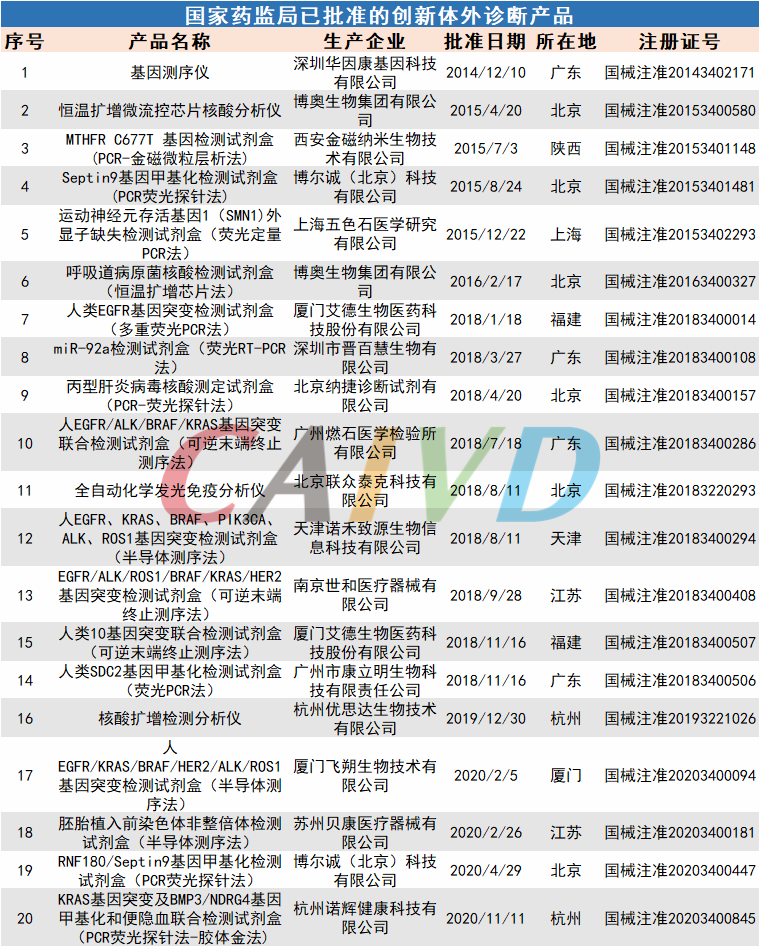
自《创新医疗器械特别审批程序》发布以来,截至统计,体外诊断领域已批准20个创新产品上市。从2014年基因测序仪(国械注准20143402171)到最近的KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)(国械注准20203400845)获批以来,一批创新性强、技术含量高、临床需求迫切的创新产品上市,填补了相关领域的空白,更好的满足了人民群众的健康需求。
从批准产品所在地来看,产业大省创新医疗器械数量排名靠前,分别是北京6个、广东4个、福建2个、杭州2个、江苏2个、厦门1个、陕西1个、上海1个、天津1个。从批准产品的类型来看,体外诊断类设备3个,体外诊断试剂17个。
这些创新产品核心技术都有我国的发明专利权或者发明专利已经申请国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。
为更好地实施创新医疗器械特别审批制度,2018年11月,国家药监局发布了新修订的《创新医疗器械特别审查程序》。修订后的程序设置更科学合理,据药监局2019年统计,对创新优先平均审评审批时间较其他普通三类首次注册产品平均压缩83天,创新产品从研发到上市的时间进一步缩短,有利于进一步集中力量,提高效率,促进体外诊断产业创新发展。
近年来,国家加大了对国内体外诊断企业的扶持力度,出台多项鼓励政策以推动行业创新发展。《“十三五”国家战略性新兴产业发展规划》中提出加速发展体外诊断仪器、设备、试剂等新产品,推动高特异性分子诊断、生物芯片等新技术发展,支撑肿瘤、遗传病及罕见病等体外快速准确诊断筛查;《十三五||国家科技创新规划》提出研发一批重大疾病早期诊断和精确治疗诊断试剂以及适合基层医疗机构的高精度诊断产品,提升我国体外诊断产业竞争力;《 中 国 制 造 2025》提出提高医疗器械的创新能力和产业化水平;《关于促进首台(套)重大技术装备示范应用的意见》健全优先使用创新产品的政府采购政策,对首台套等创新产品采用首购、订购等方式采购,促进首台套产品研发和示范应用。其他使用国有资金的项目参照政府采购要求,鼓励采购首台套产品等。
就体外诊断产业而言,一系列扶持政策的出台对企业创新产品的问世和行业发展大有利好。对于企业而言,产品才是王道!












 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


