发布时间:2016年10月26日
适用范围:
1.诊断或治疗罕见病、恶性肿瘤且具有明显临床优势的医疗器械、诊断或治疗老年人特有和多发疾病且目前尚无有效诊断或治疗手段的医疗器械、专用于儿童且具有明显临床优势的医疗器械、临床急需且在我国尚无同品种产品获准注册的医疗器械。
2.是列入国家科技重大专项或国家重点研发计划的医疗器械。
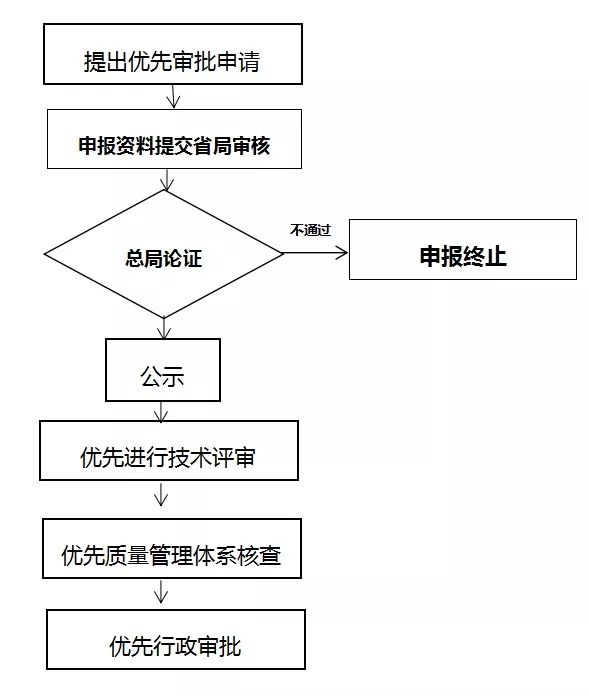
应急审批程序是为保证应对突发公共卫生事件的需要,在规定时限内快速完成医疗器械注册审批相关工作。
创新医疗器械特别审批程序是针对具有核心技术发明专利、国际领先、国内首创、具有显著的临床应用价值等情形的医疗器械,采取按照早期介入、专人负责、加强沟通、优先办理的原则予以支持。
本程序与应急审批程序、创新审批程序的目的和内容不同。
创新特别审批是申请人已完成产品的前期动物研究并具有基本定型产品即可申报。而优先审评是申报人完成临床试验与注册资料准备后,需与首次注册合并申请。
 /3
/3 