中国收藏 II《人类遗传资源国际合作临床试验》 备案范围和程序
2019-11-15 09:54|
编辑: 面气灵|
查看: 5864|
评论: 0|来源: 科技部、药品圈整理
摘要: 很长一段时间,小编没有关注“人类遗传资源管理”方面的讯息了。自2019年7月1日起施行《中华人民共和国人类遗传资源管理条例》(以下简称《条例》)以来,朋友圈里讨论/吐槽“人遗备案/审批”的现象少了许多,但近几日 ...
很长一段时间,小编没有关注“人类遗传资源管理”方面的讯息了。自2019年7月1日起施行《中华人民共和国人类遗传资源管理条例》(以下简称《条例》)以来,朋友圈里讨论/吐槽“人遗备案/审批”的现象少了许多,但近几日,这类现象又开始有所抬头了。小编不知道,很多没有亲自接触过“人遗申请”事宜的人,一直在吐槽“人遗管理”的原由在哪?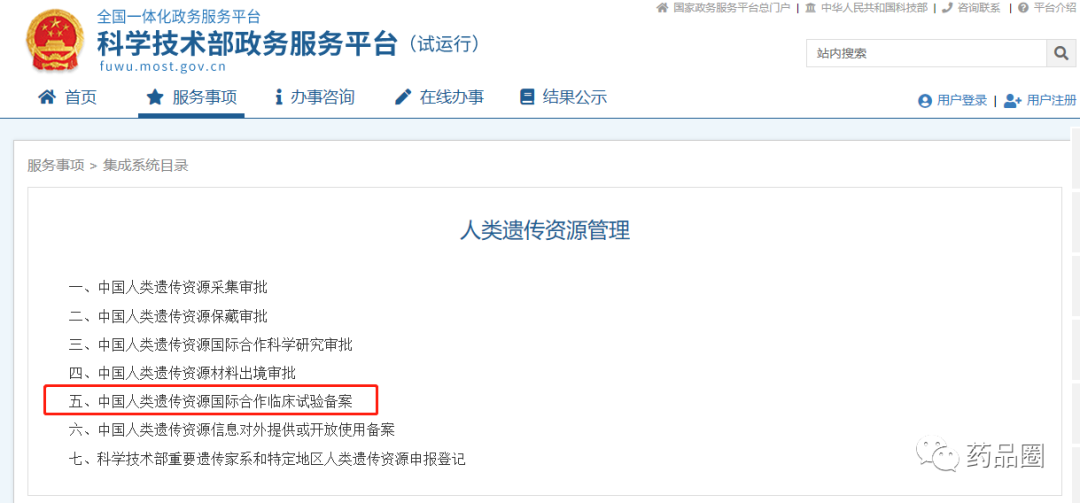
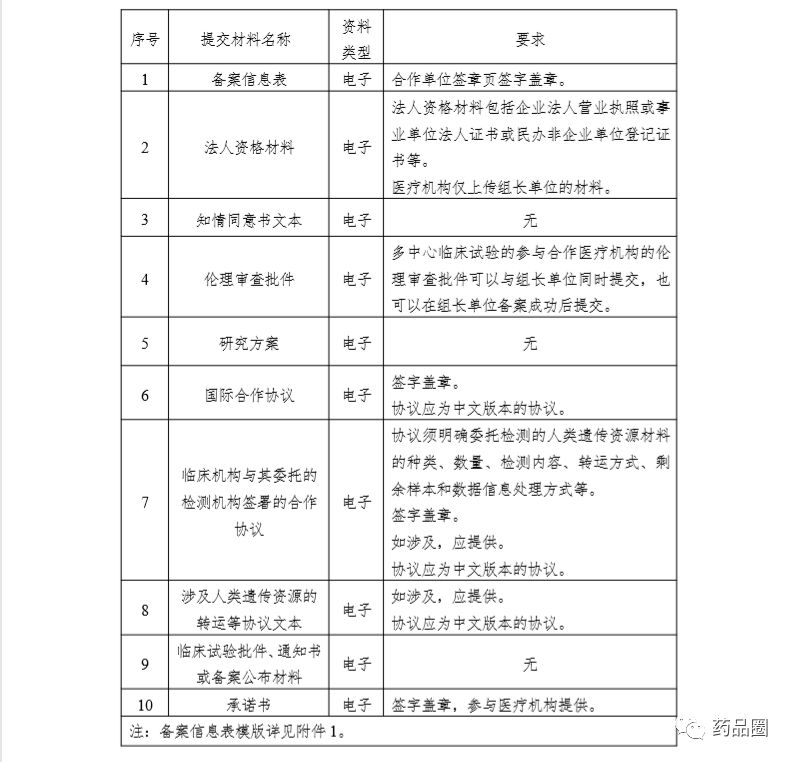

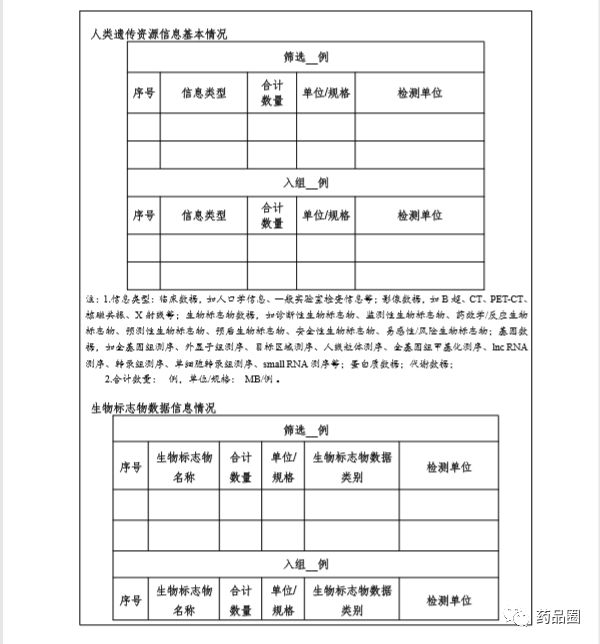
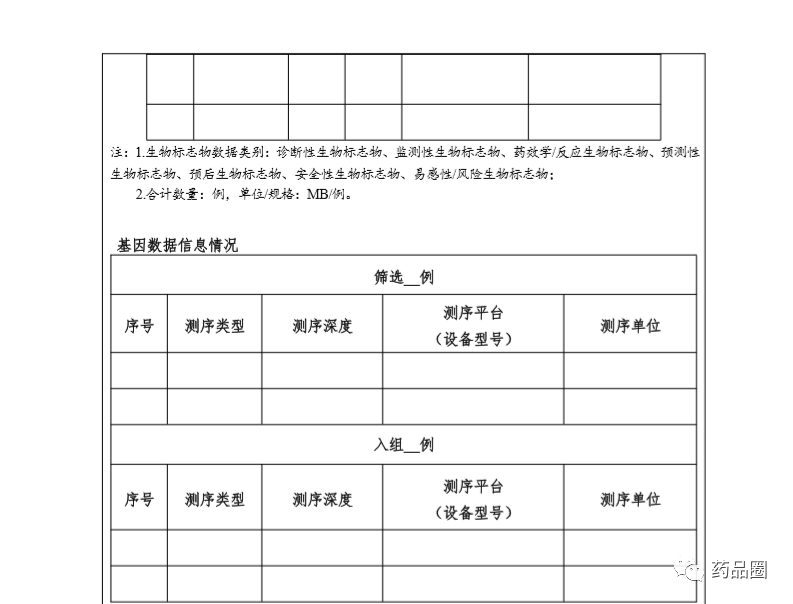
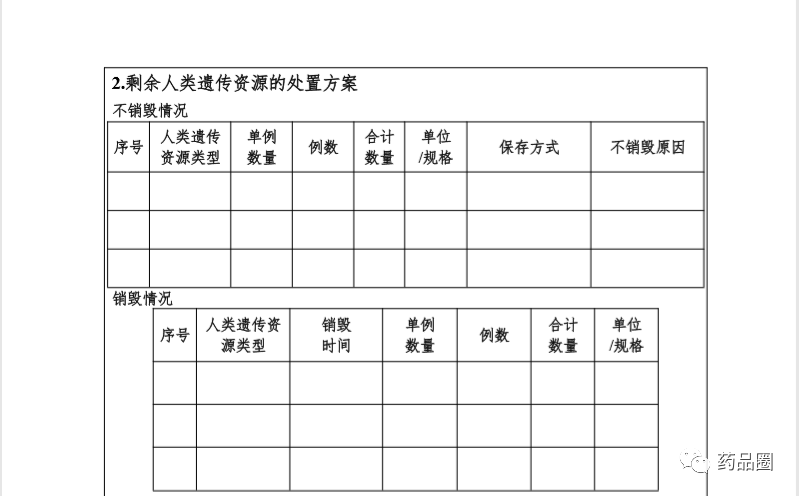
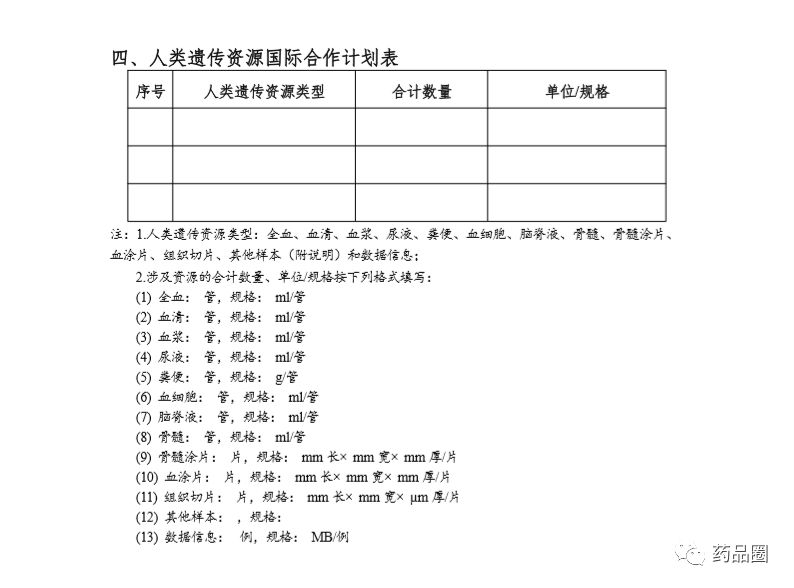
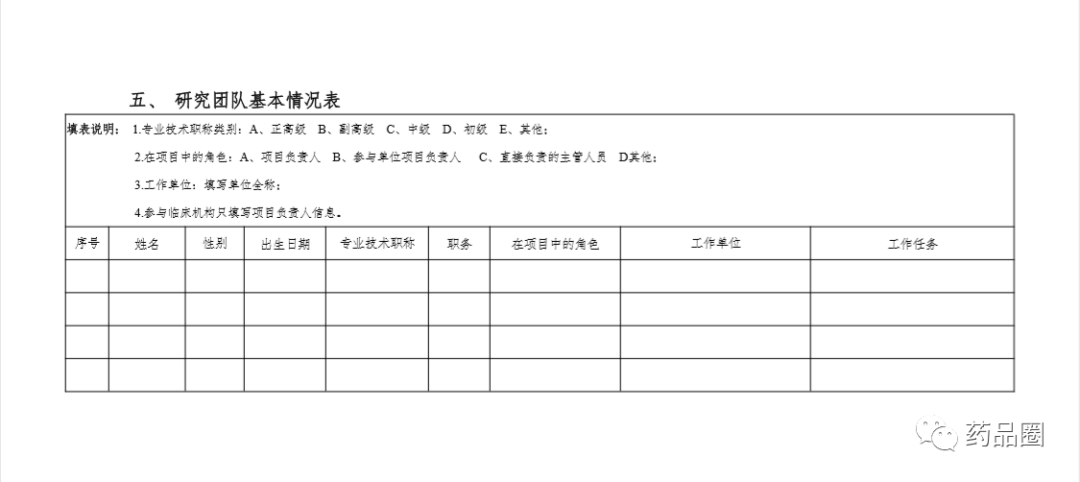
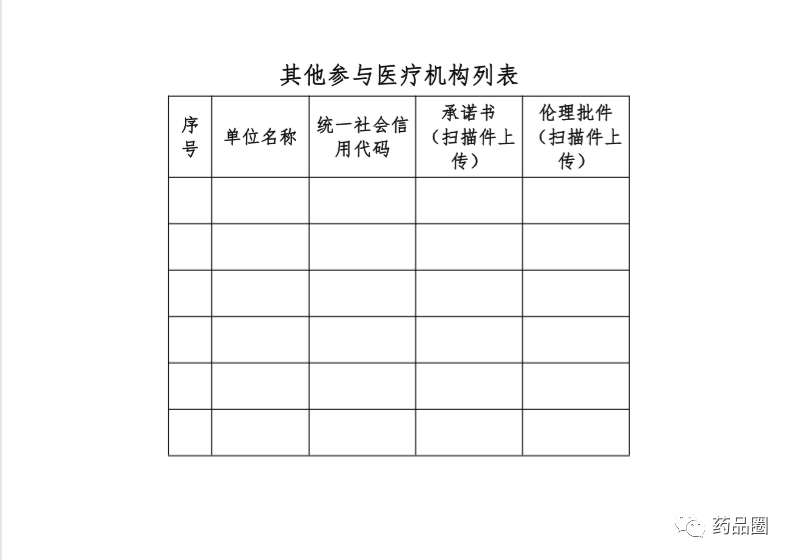
填写说明
1.合作方是指参与合作的所有中方单位、外方单位,包括临床试验申办方、医疗机构(组长单位)、合同研究组织。
2.填报单位为申办方或医疗机构(组长单位),且为中国境内依法成立的法人单位。
3.合作方应认真阅读《中华人民共和国人类遗传资源管理条例》《中国人类遗传资源国际合作临床试验备案范围和程序》,所备案内容须符合要求。
4.备案信息表内容须实事求是、准确完整、层次清晰。合作方须对备案材料的真实性、完整性、准确性、规范性负责。
5.填报单位根据网上平台提示在线填写备案信息表。信息表正文 部分统一用仿宋小四号字填写,行间距1.5倍。凡不填写的内容,请 用“无”表示。外来语要同时用原文和中文表达,外文缩写首次出现时,须注明全称。 
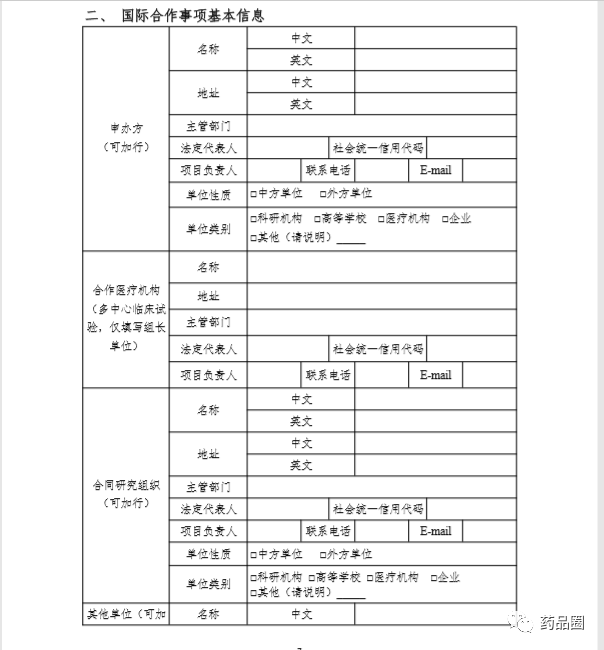

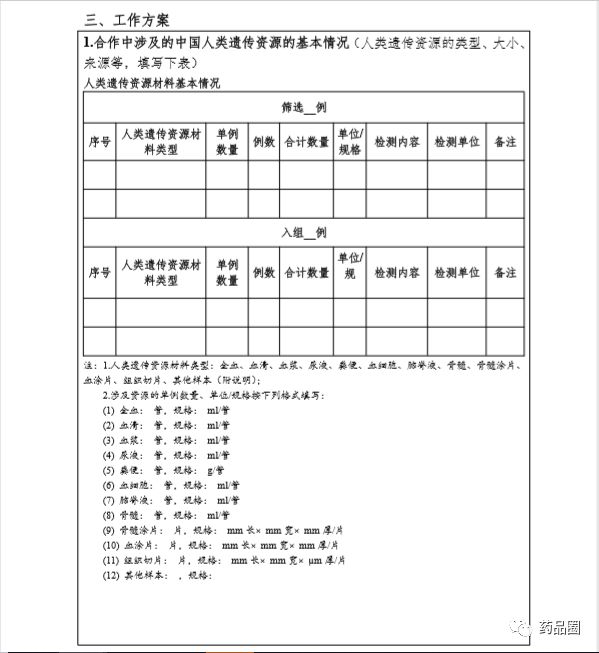






|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 