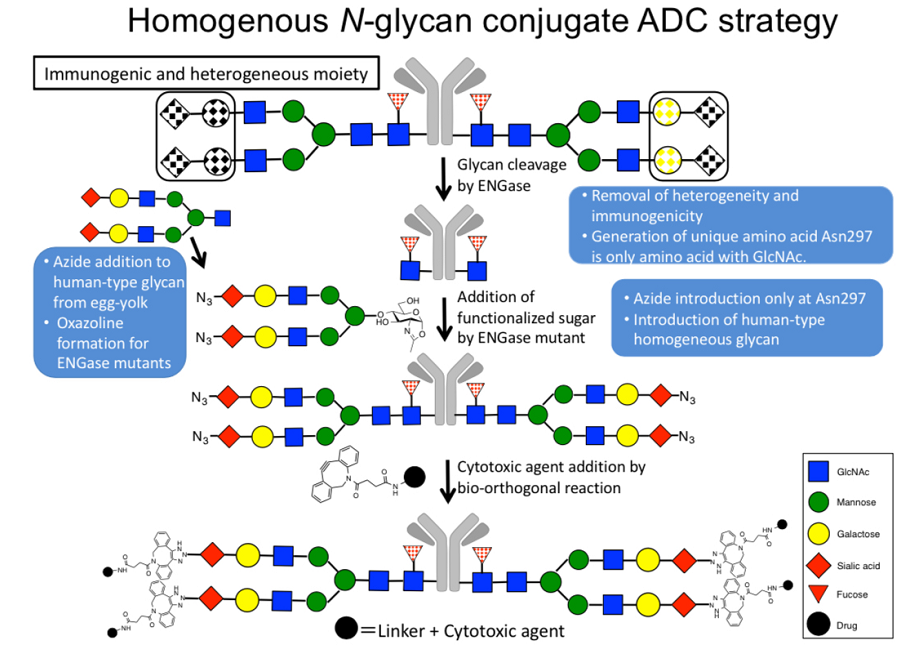
抗体-药物偶联物(ADC)的特性和性质受到结合方法和结合位点的显著影响。将药物载体与抗体共价结合的传统方法通常采用化学偶联法,将药物与半胱氨酸的二硫键或赖氨酸的氨基结合。这种方法产生的ADC产品存在产品特性不均匀、亚群可能导至循环半衰期缩短、效力降低以及脱靶效应等问题。为了解决这些问题,人们开发了多种特异性结合策略,如引入非天然氨基酸、工程化半胱氨酸、酶促连接以及N-糖基重构等方法。人源化IgG,其Fc端的N297位点带有复杂的N型糖基化。IgG的糖基化导至Fc形成马蹄形结构,这对IgG与其受体之间的相互作用非常重要。糖基偶联作为一种定点偶联技术,可以得到在循环系统中稳定的 ADC 化合物,相比随机偶联具有更好的治疗效果,是目前 ADC 领域的研究热点之一。IgG抗体的 Fc端糖基化作为偶联位点很有意义,因为它们的位置覆盖在Fc端,远离抗原结合位点,而且与氨基酸相比,它们的化学组成不同,使得特定的化学修饰成为可能。目前可用Fc端糖基化偶联技术有:糖代谢工程、糖转移酶处理结合糖氧化、内糖苷酶和转移酶处理结合酮或叠氮化物标记(图1)。Fc端糖基的核心可以通过选择性高碘酸盐氧化修饰,然后与酰肼毒素小分子反应,形成具有完整免疫反应性的腙连接缀合物。代谢糖基化工程已经通过在细胞培养基中补充6-硫代过乙酸盐来实现,并以这种方式在糖基的核心焦点处加入巯基。所得ADC证明具有细胞毒性,并显示保留抗原结合和良好的稳定性。通过氧化和肟连接,生物活性化合物可以在天然Fc糖基上通过酶促反应偶联到唾液酸上。唾液酸很少出现在重组IgG上,因此需要将半乳糖转移以获得G2糖基,然后再转移唾液酸。唾液酸暴露于高碘酸盐氧化下,形成醛基,可以与携带细胞毒性药物的氨基基结合,这一过程已被证明可以诱导蛋氨酸氧化,从而影响FcRn的结合。与基偶联ADC相比,以这种方式构建的ADC的DAR值为1.6,与巯基偶联的ADC相比,在体内和体外均显示出预期的剂量响应曲线。类似的方法使用酶催化半乳糖和叠氮修饰唾液酸的两步转移,允许无铜点击化学,可获得DAR为4.3的ADC,这种方法可以通过Fab糖基化的偶联来解释。半乳糖残基可用于修饰,包括使用β-1,4半乳糖苷酶去除半乳糖,然后使用工程半乳糖转移酶(GalT)将半乳糖衍生物转移到支链的GlcNAc上。使用工程化GalT进行位点特异性抗体偶联的方法是通过氧化使用酮标记的糖。工程GalT还用于将GalNAz转移到分支的GlcNAc上,该程序可作为Siteclick技术使用。然后可以使用菌株促进的无铜点击化学将环氯炔修饰的标签偶联到叠氮化物上。对于成像应用,当将抗体与螯合剂和放射性核苷酸(如铜标记的四嗪或锆和Alexa Fluor 680的混合物偶联时,该方法已被证明是成功的。最近,该技术已被应用于将抗体与整合剂和细胞毒性药物偶联,以获得具有抗肿瘤活性的联合正电子发射断层扫描(PET)成像。 IgG特异性内糖苷酶的发现使得糖基结构均质化和暴露天然IgG聚糖的核心GlcNAc作为偶联靶标成为可能。EndoS和EndoS2都是产自化脓链球菌的内糖苷酶,经鉴定可裂解壳聚糖核心中的Fc端糖基化,使GIcNAc附着在天冬酰胺上。EndoS2,工程GalT和click-chemistry的组合在商业上可以作为GIyCLICK®获得,本文介绍了这种偶联技术的方法。内糖苷酶处理后,使用工程半乳糖转移酶GaIT(Y289L)和UDP-GaINAz对暴露的GIcNAc进行修饰,得到一种叠氮化物,可用于生物相容性无铜菌株促进的叠氮化物-炔化学反应(SPAAC),具有选择的环胱氨酸功能化标记(图2)。一种未公开但可能类似的方法强调了IgG的保守糖基化位点是这种类型结合的最佳结合位点。Endos也发生了突变,以驱动转糖基化和合成N-糖基与非天然唾液酸的结合,从而在四个末端唾液酸上偶联。使用图2所示的GIyCLICK技术,所得偶联物显示出完整的免疫反应性,如SPR分析所示(图3),位于Fc区域的DAR为2.0(图4),以及均匀的HIC谱(图5)。重要的是,糖基的去除破坏了与Fc-y受体的相互作用,但保留了与FcRn的结合。
图2 GlyCLICK偶联结合了两个酶的步骤与以下无铜叠氮化物-炔点击化学步骤。(a)GlyCLICK偶联过程示意图。(1) Endos2(作为固定化GlycINATOR)水解IgG的Fc 糖基,暴露核心GIcNAc。(2) 工程化的β-1,4-半乳糖转移酶GaIT(Y289T)将GaINAz从UDP-GaINAz转移到GIcNAc上,生成叠氮化物活化的IgG。(3) 利用环炔功能化标记,通过菌株促进的无铜点击反应,该标记在IgG的Fc结构域与GalNAz的两个可用叠氮化物共轭。(b)菌株促进叠氮化物.炔点击化学(SPAAC)原理。叠氮化物激活的蛋白(灰色圆圈),作为抗体的Fc/2部分,与环胱氨酸修饰的分子反应,产生通过三唑连接的共价偶联。在这个例子中,显示了二苯并环辛泰(DBCO)功能化的毒素分子。 
图4 曲妥珠单抗- DM1毒素偶联物(T-GIyCLICK-DM1)的质谱分析显示Fc上的位点特异性偶联物。采用GIyCLICK共轭法对不同步骤后的亚基进行LC-MS分析所得的反卷积质谱。在最后的共轭步骤后,仅在Fc上看到了具体和完整的质量变化,导至DAR为2.0。分析分别在未还原(Fc)和还原(LC和Fd)条件下进行。采用RP-HPLC进行分离,使用ESI-Q-TOF质谱仪进行分析(见注7)。图5 曲妥珠单抗对照和相应的DM1毒素偶联物的疏水相互作用分析。与曲妥珠单抗对照相比,曲妥珠单抗- dm1(T-GIyCLICK-DM1)表现出均匀的峰值和轻微的疏水性变化(见注16)这表明在保持预期药代动力学特征的同时,有可能降低脱靶效应。一种使用GIyCLICK与高效吡咯苯二氮卓(pyrolobenzodiazepine,PBD)二聚体偶联的抗uPARAP抗体在体外具有有效的肿瘤细胞杀伤作用,对离体肉瘤患者样本有效,并在体内以2mg/kg的单剂量治愈小鼠。 以下介绍一种获得糖位点特异性ADC的实操方法,该方法使用Fc-聚糖的两步酶重构,然后是叠氮化炔无铜点击化学。 1、50 KMWCO离心过滤单元,样品量0.5 ml 。1、在pH 7.4的25m MTBS中,100-250 μg抗体。抗体存在于非磷酸盐缓冲液中,最好是基于Tris的缓冲液,无载体蛋白和/或叠氮化物(见注1)。2、GIyCLICK@叠氮化物活化试剂盒,用于活化250μg抗体。(见注2)。3、25 mM Tris pH 7.4, 0.15 M NaCI (TBS)1、GIyCLICK叠氮化物活化试剂盒,用于活化250 μg抗体(见注2)。2、25 mM Tris pH 7.4, 0.15 M NaCI (TBS)(见注3)。2、25 mM Tris pH 7.4, 0.15 M NaCI (TBS)(见注3)。所描述的方法是基于使用GIyCLICK叠氮化物激活试剂盒(见注2) ,250μg抗体只有当250 μg抗体的体积大于200 uI时,才需要进行浓缩步骤(见注6)1、50KMWCO离心过滤装置,样品量0.5 ml,加入500 μl H20冲洗,盖上装置。2、5000rpm离心6min,确保过滤单元的帽带和一个膜板朝向转子中心。4、在预配制的50KMWCO离心过滤装置中加入足够体积的抗体溶液,使其含有100-250ug的抗体。例如,如果抗体浓度为1 mg/ml,加250 μl。5、5000rpm离心2-6分钟,确保过滤单元的帽带和一个膜板面向转子中心。7、如果过滤单元中的抗体体积大于200 μl,则在5000rpm下再离心2分钟,直至合适体积。9、采用1000 rpm离心3分钟,收集浓缩抗体。收集后,收集管中浓缩抗体的量应约为150-200 μ1。如果样品中含有磷酸盐和/或叠氮化物,则需要进行缓冲交换步骤(见注1)。10、断开脱盐柱的底封。松开盖子(不要将盖子拆下)。11、将色谱柱置于收集管(1.5-2 ml)中,在1500rpm下离心1分钟,除去储存液。13、在树脂上加300 μI TBS缓冲液。1500rpm离心1 min,倒掉废液。15、吸干色谱柱底部,去除多余的液体。将色谱柱放入新的收集管中(1.5-2 ml)16、将抗体溶液加入至柱子中(100-200 μ1)。17、在1500rpm下离心2分钟,使抗体在TBS缓冲液中。GlycINATOR (EndoS2)是一种针对IgG抗体的特异性内糖苷酶,它能水解Fc -糖基化位点的所有糖型。该酶作用于壳聚糖核心,并使核心GIcNAc保持完整。GIVCINATOR将所有人源化IgG亚类和许多其他物种(如小鼠、大鼠和猴子)的IgG去糖基化。本步骤使用GIyCLICK试剂盒中带有固定化GIyCINATOR的重力柱。1、断开固定化GlyCINATOR柱的底部塑料盖,轻轻打开盖子。保存瓶盖,旋转柱的瓶盖和瓶盖在后期使用孵化。6、在树脂顶部加300 μITBS缓冲液,盖上盖子重新封柱,轻轻松开盖子。7、在200 rpm下将色谱柱离心1分钟,丢弃流通液。10、立即将抗体溶液(100-200 μ1,含最多250 μg抗体)加入色谱柱中,用盖重新密封色谱柱。11、注意通过手动翻转柱端对端,使介质完全悬浮,确保柱内有流动。13、取下底帽,将色谱柱置于干净的微离心管(1.5-2 ml)中,轻轻松开盖子。15、接上底盖,加入50 μI TBS,用盖封柱。17、取下底帽,将色谱柱置于干净的微离心管(1.5-2 ml)中。松开盖子。21、此时可选的是通过分析来验证去糖基化用质谱分析样品(图4)(见注7)。在这个酶的步骤中,一个工程的半乳糖转移酶GaIT (Y289L)将GaINAz附着在由GlycINATOR生成的Fc端糖基的核心GIcNAc上,详见3.2(见注释2)。1、将30 μl Buffer添加剂和3.2第20步中修饰抗体的混合溶液加入到含有冻干UDP-GaINAz的管中(见注释8),制备叠氮化物修饰溶液。4、加入25 μl的GalT酶溶液。最终反应体积为400 μI(见注2)。未使用的酶可在2-8℃保5、轻微上下混合溶液。用Parafilm®或类似物包裹管盖这一步将通过使用自旋过滤装置滤除多余的UDP-GaINAz。在离心过程中,锥形收集管连接在装置上。1、从50 KMWCO离心过滤装置顶部取下锥形收集管,样品容量为2ml。2、向50 KMWCO离心过滤装置中加入2ml TBS。3、1200 rpm离心10分钟,确保过滤单元的一个膜面朝向转子中心。5、将1.6 ml TBS和3.3的步骤6中叠氮修饰抗体400 μl加入预配制的50KMWCO离心过滤装置中。6、1200rpm离心6分钟,确保过滤单元的一个膜板面朝向转子中心。8、在50 KMWCO离心过滤装置中向保留物中加入足够体积的TBS,使总体积达到2ml。9、1200rpm离心10分钟,确保过滤单元的一个膜板面朝向转子中心。12、如果离心过滤单元中的抗体体积大于约200 μl,则应通过再次离心来减少过滤单元中的体积,例如,在1200rpm下再离心5分钟或直到达到适当的体积13、取下滤液管,将带抗体的离心过滤单元倒置到锥形收集管中。15、将抗体从锥形收集管转移到1.5 ml离心管中(见注9)。17、可通过MS分析样品(图4)来验证叠氮化物在Fc处的活化(添加GaINAz)(见注7)。在这一步中,叠氮化物活化的抗体与cycloctyne修饰的标签在菌株促进的无铜点击化学反应中反应,形成抗体偶联物。1、在DMSO中重新配制环辛碱修饰的标签,浓度为2-5 mM(见注释10和11)。2、在1.5 ml离心管中加入225 μl叠氮活化的TBS抗体(子标题3.4,步骤16),最多添加25μl环辛炔修饰标签。添加环辛碱修饰标签的量取决于所使用的特定环辛碱标签(见注12)。4、盖上管子并用Parafilm@或类似材料密封,这一步将通过使用自旋过滤装置滤除多余的环辛碱修饰标签。TBS或PBS可用于纯化和收集修饰抗体。在离心过程中,锥形收集管附着在装置上。1、从50 KMWCO过滤装置顶部取下锥形收集管,样量2 ml。2、向50 KMWCO过滤装置中加入2ml所需的缓冲液,如PBS或TBS。3、1200rpm离心10分钟,确保过滤单元的一个膜板面朝向转子中心。5、将1.6 ml所需的缓冲液(如PBS或TBS)和标题3.5步骤5中的偶联抗体加入预配制的50KMWCO过滤装置中。6、1200 rpm离心10分钟,确保过滤单元的一个膜板面朝向转子中心。8、在50 KMWCO离心过滤装置中加入足够体积的所需缓冲液,如PBS或TBS,以达到2ml的总体积。9、1200rpm离心10分钟,确保过滤单元的一个膜板面朝向转子中心。12、取下滤液管,将带抗体的离心过滤单元倒置到锥形收集管中。14、将抗体偶联物从锥形收集管转移到1.5 ml微离心管中。抗体偶联物现在可以在+4-8℃下避光保存(见注释14)。15、用Nanodrop测定蛋白质浓度(见注15)。16、可通过这个过程完成完整的偶联, MS分析样品DAR =2(图4)(见注释7)。以上操作步骤为笼统大致的一个步骤,更多细化的步骤还需要更具不同的分子性质进行优化。1、抗体需存在于无磷酸盐缓冲液中,无载体蛋白和/或叠氮化物。在叠氮化物附着步骤中,磷酸盐会引起沉淀。溶液中的游离叠氮化物会争夺可用试剂,导至偶联不完全。关于抗体缓冲液的调整,请参见标题3.1。2、GIyCLICK叠氮化物活化试剂盒包含试剂 B-1,4-半乳糖基转移酶(Y289L)(GalT(Y289L)),UDP-GaINAz,缓冲添加剂,固定化GlyCINATOR(Endos2),以及偶联方案所需的其他成分。叠氮化物活化试剂盒可用于活化量大于250μg的IgG。3、25 mM TBS pH 7.4 (25 mM Tris pH 7.4,0.15 M NaCl)可以是购买20 xTBS原液。4、环辛泰修饰的标签可以是二苯并环辛泰(DIBO或DBCO)。在这项工作中使用了一种DBCO功能化的毒素分子。6、抗体的最大体积为200 μ1,对于在接下来的步骤中获得正确的浓度以确保反应完全至关7、样品制备用于MS分析去糖基化、叠氮活化和最终ADC(图4)。抗体样品与TBS中的Genovis AB混合,在37℃下孵育30分钟,生成Fc和F(ab)2片段。对于还原后的样品,加入DTT和盐酸胍,在37℃下再孵育30分钟。片段被分离在一个Acquity UPLC BEHC4蛋白柱, 1.7 μm 2.1×100 mm(Waters),用0.1% FA溶于Milli Q水(溶剂A), 0.1% FA溶于95%乙腈(溶剂B)。在10%B的条件下,保持13 min使样品脱盐,然后增加1 min至25%B。在25%B和36% B之间,以0.2 ml/min的流速在50℃下分离12 min。柱在90% B下洗涤3 min,然后再进行整修。LC连接到Q-TOF Impact Il(Bruker),配备电喷雾电离源,分辨率为50,000。源设置为毛细管电压4.5 kV,干燥温度220_C,雾化气体压力1.8 Bar,雾化气体流量8 l/min。质量范围为300m/z~3000 m/z使用MaxEnt算法和SNAP算法确定的亚基的单同位素分子量对获得的数据进行反卷积。8、GIyCLICK试剂盒中提供的UDP-GaINAz是冻干的,小瓶中含有0.22 mg。未使用的重组UDP-GaINAz可以保存在 20 ℃。9、在这一阶段,抗体可以保存,避光, 2-8℃,供以后标记偶联。10、采取适当的安全预防措施是很重要的,因为环辛基修饰的标签是一种有毒分子。确保使用足够的防护用品,并根据试剂的安全数据表遵循程序和规定。11、在实验中,使用了DBCO-PEG4-Ahx-DM1 12、环辛基修饰的标记物和叠氮化物活化的抗体之间的摩尔比取决于标记物(环辛基连接毒素)和待偶联的抗体。摩尔比可以在10:1到30:1之间变化。如果与抗体的摩尔比过高,疏水性较强的标签可能会引起沉淀。建议在进行较大的偶联之前进行小规模的测试,例如,从比例10:1(标签:抗体)开始,并通过LC-MS分析以评估偶联度(图4)(见注释7)。13、如果期望抗体浓度大于2mg/ml,可通过长时间离心减少过滤单元的体积,例如:,在1200rpm下再离心5分钟,或直到达到适当的体积。14、叠氮化钠或硫柳汞可添加到最后浓度为0.02%(w/v)的长期存储。15、生成的ADC的蛋白质浓度可以通过Abs 280和正确的摩尔消光系数轻松测量。如果需要,也可以在去糖基化步骤(Subheading3.2,步骤20)之后用Abs280测量蛋白质浓度。叠氮化物激活后用Abs280测量蛋白质浓度会产生误导,因为叠化物会影响吸光度280纳米。16、样品在25 mM磷酸钠缓冲液中使用ButyINPR HIC色谱柱进行分析pH 7.0, 1.5 M硫酸铵,用20%异丙醇低盐洗脱。| Antibody Conjugations via Glycosyl Remodeling Hanna Toftevall, Hele´n Nyhle´n, Fredrik Olsson, and Jonathan Sjo¨ gren |
|  /3
/3 