IF=41,浙江大学平渊等合作开发光/声操控纳米器件,实现瘤内基因编辑 ...
2023-5-23 16:20|
编辑: 沙糖桔|
查看: 2697|
评论: 0|来源: iNature
摘要: 该研究报告了一种温度敏感的基因组编辑纳米装置
针对实体肿瘤的过继T细胞治疗受到肿瘤细胞凋亡抵抗机制和细胞外免疫抑制肿瘤微环境的限制。基因科技网讯:2023年5月15日,浙江大学平渊和中国科学院过程工程研究所魏炜团队合作在Nature Nanotechnology(IF=41)在线发表了题为“Non-invasive activation of intratumoural gene editing for improved adoptive T-cell therapy in solid tumours”的研究论文,该研究报告了一种温度敏感的基因组编辑纳米装置,它可以提供一个带有外部触发器的Cas9编辑器,可用于编辑肿瘤细胞的基因组,以减少对凋亡的抵抗,并通过温和的加热触发器调节肿瘤微环境。在局部或全身递送Cas9后,通过非侵入性近红外(NIR)光或聚焦超声(FUS)诱导轻度加热来激活Cas9,从而启动肿瘤细胞中HSP70 (HSPA1A)和BAG3的同步基因组编辑。这破坏了肿瘤细胞对过继T细胞的凋亡抵抗机制。NIR或FUS诱导的轻度热效应通过破坏物理屏障和免疫抑制来重塑细胞外肿瘤微环境。这促进了过继T细胞的浸润,增强了它们的治疗活性。在模拟一系列临床适应症的不同小鼠肿瘤模型中,包括基于人源化患者异种移植物的肿瘤模型中,已经证明了温和的热Cas9递送。因此,该研究表明无创热传递Cas9可显著提高肿瘤浸润淋巴细胞和嵌合抗原受体T的治疗效果,具有临床应用潜力。另外,2022年9月14日,浙江大学刘祥瑞,平渊及周天华共同通讯在Science Advances 在线发表题为“Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases”的研究论文,该研究报告了一种以前未知的基因组编辑递送系统,名为 ExosomeRNP,其中 Cas9 RNP 通过电穿孔被加载到从肝星状细胞中分离出来的纯化外泌体中。 ExosomeRNP 促进了 RNP 在体外的有效胞质递送,同时在体内特异性地积累在肝组织中。ExosomeRNP 在急性肝损伤、慢性肝纤维化和肝细胞癌小鼠模型中显示出强大的治疗潜力通过分别靶向 p53 上调的凋亡调节剂 (PUMA)、细胞周期蛋白 E1 (CcnE1) 和 K(赖氨酸)乙酰转移酶 5 (KAT5)。总之,该研究开发的ExosomeRNP为肝脏疾病的精确和组织特异性基因治疗提供了一个可行的平台(点击阅读)。过继性细胞转移(ACT)治疗实体肿瘤的效果经常受到肿瘤微环境(TME)提出的物理和免疫障碍的影响,这些障碍会损害过继性T细胞浸润、靶向和杀死肿瘤细胞的能力。首先,具有异常血流特征的肿瘤血管失调以粘附分子表达下调为特征,从而限制了T细胞从内皮向肿瘤外渗。其次,从内皮细胞进入肿瘤的T细胞遇到实体瘤致密的细胞外基质,限制了过继T细胞在瘤内的深度浸润。除了上述物理屏障外,大量的免疫抑制细胞和免疫抑制细胞因子也极大地抑制了浸润的过继T细胞的抗肿瘤功能和增殖。尽管已经做出了许多努力来重塑细胞外TME以解决物理和免疫障碍,但肿瘤细胞中抗凋亡蛋白稳定的对T细胞诱导的细胞毒性的抵抗也极大地损害了肿瘤细胞对过继T细胞的敏感性。在机制上,T细胞通过穿孔素介导的途径在肿瘤细胞的膜上形成孔,然后启动颗粒酶B (GZMB)依赖性的细胞内凋亡,从而独特地诱导细胞死亡。然而,这种细胞死亡途径经常被上调抗凋亡蛋白所破坏,以停止由T细胞启动的细胞死亡信号,从而损害T细胞的抗肿瘤能力。考虑到这些挑战,该研究提出了一种非侵入性策略来操纵肿瘤细胞的细胞内和细胞外调节的肿瘤内基因组编辑,这可以大大提高实体肿瘤对过继T细胞的敏感性。先前的一些研究表明,HSP70 (HSPA1A)和BAG3在各种癌症类型中高表达,它们的细胞内活性对癌细胞的存活至关重要。最近的研究结果表明,HSP70和BAG3也可以调节TME以促进癌症的进展和对治疗的耐药性,包括T细胞介导的细胞毒性和癌细胞的化疗。此外,该研究的生物信息学分析显示,在不同类型的癌症患者中,高水平的HSP70和BAG3与较差的生存率呈正相关,并且这两个指标与抗凋亡BCL2家族表达密切相关。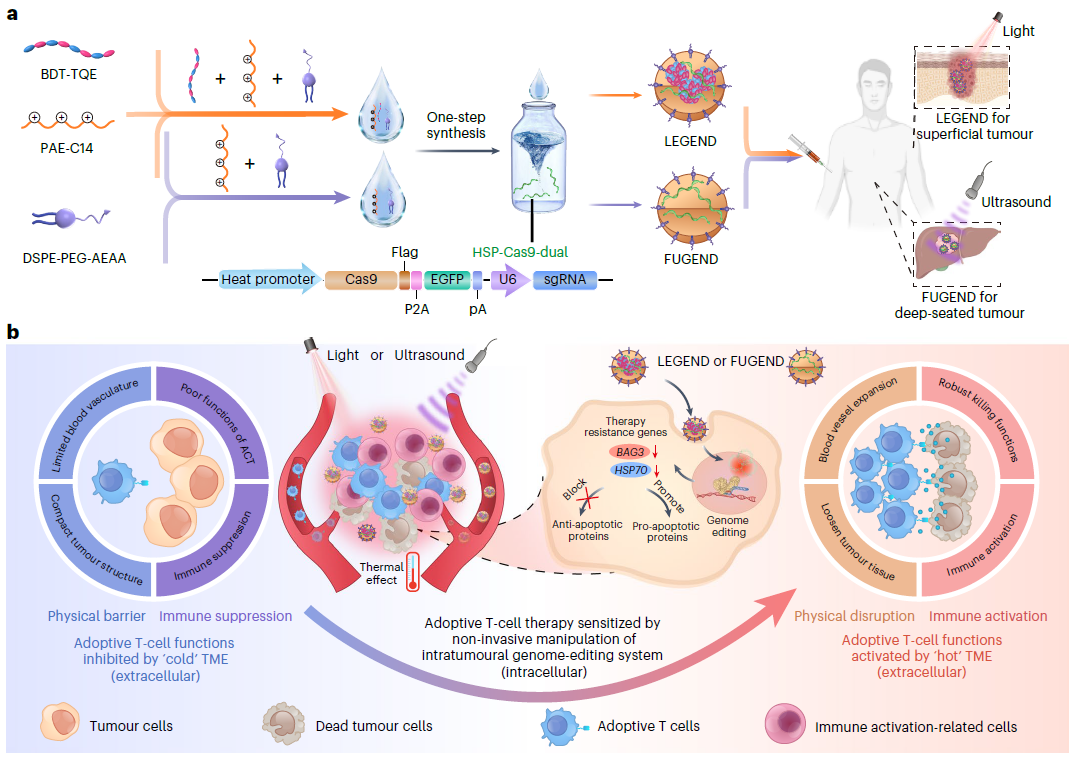
纳米颗粒制备和治疗肿瘤机理示意图(图源自Nature Nanotechnology )基于上述证据,该研究首先开发了一种纳米器件,用于在体内通过非侵入性近红外(NIR)光或聚焦超声(FUS)激活热诱导CRISPR-Cas9系统,靶向HSP70和BAG3。在给药和细胞内递送后,由近红外光照射或FUS诱导的轻度热效应不仅触发双基因组编辑以破坏肿瘤细胞的凋亡抵抗机制,而且通过打破物理屏障和免疫抑制重塑细胞外TME。通过以上两方面的协同作用,该研究验证了这种基因组编辑策略使癌细胞对两种过继T细胞,即肿瘤浸润淋巴细胞(TIL)和嵌合抗原受体T细胞(CAR-T细胞)具有极大的敏感性,并对多种肿瘤模型表现出协同治疗作用。原文链接:https://www.nature.com/articles/s41565-023-01378-3
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 