目前临床上主要通过叶酸结合蛋白(folate-binding protein,FBP)法检测总叶酸(total folate,tFOL),该方法特异性较差,不同检测系统间存在较大差异。同位素稀释液相色谱串联质谱(isotope dilution liquid chromatography tandem mass spectrometry,ID-LC-MS/MS)法更为灵敏和特异,但该方法在检测FA时,不同实验室结果差异较大。鉴于叶酸在临床应用中的重要性,美国疾病控制与预防中心(Centers for Disease Control and Prevention,CDC)、美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)等组织通过建立参考方法、研制参考物质,推进叶酸检测标准化,以促进结果的准确可比。
目前,叶酸的检测方法主要有微生物检测法(microbiological assay,MA)、FBP检测法、高效液相色谱(high performance liquid chromatography,HPLC)法和ID-LC-MS/MS法。这些方法均可对血清/血浆和红细胞叶酸进行检测。其中FBP法检测成本低,为临床样本提供快速的自动化分析,而且对实验室人员要求不高,是目前临床实验室最常用的叶酸检测方法。
(一)微生物检测法
MA法是最早应用于叶酸检测的方法,可以检测所有具有生物活性的叶酸代谢物,但不能检测缺乏生物活性的降解产物[8]。MA法检测叶酸通常使用鼠李糖乳杆菌和粪链球菌等叶酸依赖性细菌,不同的微生物需要使用不同的校准品[9]。MA法灵敏度高,但精密度较差。
随着耐氯霉素鼠李糖乳杆菌、96孔微孔板,以及冻干保护剂的引入,MA法开始广泛应用于营养状况调查中叶酸的检测[10]。
(二)叶酸结合蛋白法
由于MA法精密度差、耗时费力、通量有限,FBP检测法在20世纪70年代开始取代MA法,被广泛用于临床实验室中[2]。英国国家室间质量评价服务(United Kingdom National External Quality Assessment Service,UK NEQAS)报告显示,Roche Cobas(美国),Abbott Architect(美国),Siemens Centaur(德国),和Beckman Dxl(美国)是检测血清/血浆叶酸的最常用的平台[11]。国家卫生健康委临床检验中心最新的室间质量评价(external quality assessment, EQA)数据显示,目前我国临床实验室叶酸检测也主要采用这四个平台。除此之外,国产品牌迈瑞在国内的使用也较为广泛。
自动化FBP方法精密度高,方法内变异系数(coefficient of variation,CV)约为10%,总CV低于10%[11, 12]。然而,FBP特异性不佳,对不同叶酸代谢物具有不同的结合亲和力,这种差异可能会导至检测结果偏低[13]。此外,在营养补充的背景下,FBP法分析范围过窄(2.0~20 ng/ml),而稀释样本检测时,又存在明显基质效应。与MA法相同,氨基蝶呤、亚叶酸和甲氨蝶呤结构与叶酸相似,可与叶酸发生交叉反应。
目前叶酸检测试剂盒多使用酶联免疫反应体系,反应时间长且线性范围窄。2019年卢菲等[14]采用生物素-亲和素反应体系,开发了一种叶酸的快速检测试剂盒,线性范围可达到1.5~50 ng/ml,其他性能指标也都处于国内领先水平,有望取代国外同类型试剂盒。
(三)高效液相色谱法
HPLC法使包括多谷氨酸叶酸在内的单种叶酸代谢物定量成为可能。该方法常使用紫外检测器,但紫外检测灵敏度较低。相比之下,荧光检测器灵敏度更高,但FA缺乏荧光活性,需要在柱后氧化为荧光衍生物后,才能使用该方法定量[15]。此外,HPLC也可联合微生物检测或电化学检测[16, 17]。HPLC法现在仍被用于检测某些叶酸代谢物,但已被更灵敏、更快速的ID-LC-MS/MS检测法所取代。
(四)同位素稀释液相色谱串联质谱法
ID-LC-MS/MS法使用稳定同位素标记的内标,可以补偿前处理和检测过程中的损失,样本处理方法选择性高、检测特异性高、灵敏度和精密度良好,可完全排除氨基蝶呤、亚叶酸和甲氨蝶呤等结构类似物的干扰,因此被认为是基于HPLC方法的首选检测系统[18]。根据叶酸在溶液中的电荷状态,可以用反相吸附剂和离子交换吸附剂将叶酸与基质成分分离。反相吸附剂使用更频繁,因为血清样本通常用1%抗坏血酸溶液稀释,这促进了α-和γ-谷氨酸羧基质子化。反相吸附剂中苯基和C18吸附剂是最常用的,通常洗脱液使用一小部分有机溶剂,甲醇或乙腈,酸化以适应流动相。此外,洗脱液和流动相的酸性pH都可能影响叶酸的稳定性。同时,在使用LC-MS/MS时,必须考虑用于洗脱的高浓度盐可能会干扰电离。叶酸属于极性化合物,目前大多数质谱方法使用反相色谱柱进行分析,可达到较好的保留和分离效果。相对于反相色谱柱,亲水作用色谱柱使用较少,可能是因为流动相中的高浓度盐会干扰电离。表2例举了部分国内外已建立的ID-LC-MS/MS法。
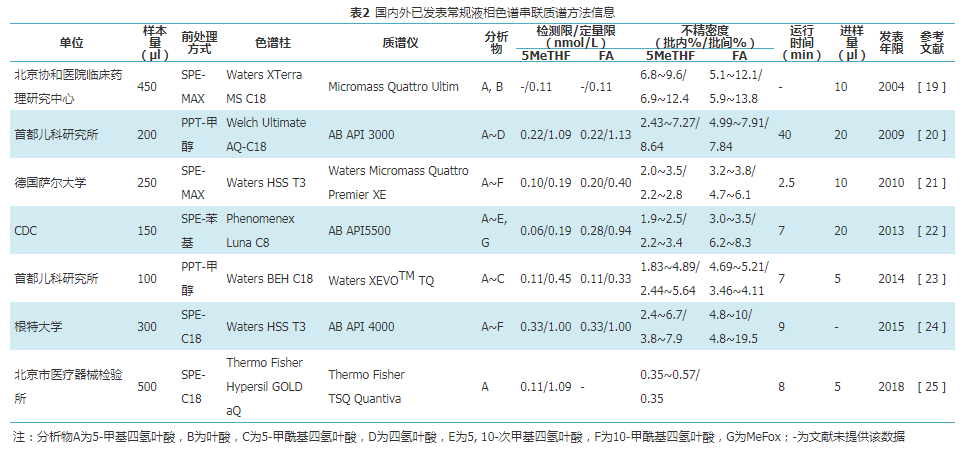
由于仪器设备和方法开发人员的水平不同,实验室能检测到的叶酸代谢物形式各不相同。而MA法和FBP法只能对tFOL定量,无法区分单种叶酸代谢物,因此质谱法与MA法或FBP法进行比较时,需要定义质谱法tFOL的组成。根据目前实验室检测能力,质谱法tFOL一般包括FA、5MeTHF和5FoTHF。此外,使用质谱法检测时还应考虑5MeTHF的氧化产物氧化产物4α-羟基-5-甲基四氢叶酸的吡嗪-s-三嗪衍生物(pyrazino-s-triazine derivative of 4α-hydroxy-5-methylTHF,MeFox)对结果的干扰。MeFox可以用于考察样本在储存或处理过程中可能受到的氧化应激程度,但是MeFox与其同分异构体5FoTHF在色谱和质谱分离过程中表现相似,很可能存在共洗脱和错误识别,如果不进行适当的分离,则会使tFOL结果产生偏差[26]。
由于液质联用仪器价格昂贵,目前ID-LC-MS/MS法在我国临床实验室很少应用。部分第三方检验所建立了ID-LC-MS/MS方法,以提供相应的检测服务,但是这些方法能够准确定量的叶酸代谢物有限[27]。此外,ID-LC-MS/MS方法也被用于我国强化食品中叶酸含量的检测[28]。
(五)检测现状
在开发参考测量程序(参考方法)前,大多数检测平台只能溯源至厂商内部标准品。在这一阶段,血清和红细胞叶酸检测系统间检测结果差异较大[12, 29]。2011年,Blackmore等[30]表示参与UK NEQAS Haematinics EQA计划的所有实验室tFOL均值与CDC ID-LC-MS/MS参考方法靶值之间有良好的一致性,但不同的方法与参考方法的一致性不同。其中,Abbott Architect与参考方法的一致性最佳,这可能是因为当时只有Abbott公司报告可溯源至WHO IS 03/178[30]。2015年,CDC开展了2次国际Round Robin研究[31],首次对血清叶酸LC-MS/MS方法可比性、精密度和准确度进行研究。研究发现,实验室检测5MeTHF的精密度和可比性和良好,而检测FA的CV较高,且检测结果差异较大[31]。2016年,挪威临床化学EQA机构Kristensen等[32]表示不同厂商的tFOL结果差异在理想偏差的范围内,并表示这可能是因为叶酸生物学变异很大,可接受标准范围相对较宽[32]。2017年UK NEQAS Haematinics计划报告红细胞叶酸的检测结果存在显著差异,方法内CV为12%~32%,总CV约为40%[11]。为了满足欧盟体外诊断器械指令98/79/EC要求,如今大多数tFOL检测系统已经重新校准溯源至IS 03/178[33, 34]。2019年,Braga等[33]研究了使用IS 03/178作为商业检测系统的通用校准品是否能够改善方法间的一致性,结果发现大多数检测系统检测结果偏高,仍然存在较大方法间CV。
国家卫生健康委临床检验中心内分泌EQA计划结果显示,2019年全国共有1 100余家实验室参加叶酸EQA计划。迈瑞组实验室间CV为11.48%~20.22%,Abbott、Roche、Siemens Centaur、新产业、Beckman DxI/DxC各组实验室间CV较小,分别为4.6%~9.6%、5.5%~10.1%、2.32%~10.86%、4%~7.26%、4.76%~7.52%。此外Siemens Centaur组和迈瑞组检测结果存在明显的正偏倚,这可能是因为校准品存在差异。贾永娟等[35]研究发现,ID-LC-MS/MS法和FBP法叶酸检测结果存在差异,并且差异与浓度相关。
综上所述,目前血清叶酸检测精密度较好,但方法间可比性不佳。使用IS 03/178校准后,不同检测系统间结果仍存在差异。为了进一步改善方法间的一致性,厂商应该在校准品的量值溯源中投入更多精力。
 /3
/3 