FDA公布2022年医疗器械注册收费标准 | 欧盟发布新冠试剂性能评估指南
2021-8-5 17:18|
编辑: 沙糖桔|
查看: 3267|
评论: 0|来源: CACLP体外诊断资讯
摘要: FDA公布2022年医疗器械注册收费标准2021年7月30日,FDA公布了2022年医疗器械评审收费标准。本次收费标准维持着一如既往的上涨趋势。该费用适用时间为 2021 年 10 月 1 日至 2022 年 9 月 30 日。其他费率:注:小规 ...
2021年7月30日,FDA公布了2022年医疗器械评审收费标准。本次收费标准维持着一如既往的上涨趋势。该费用适用时间为 2021 年 10 月 1 日至 2022 年 9 月 30 日。
其他费率: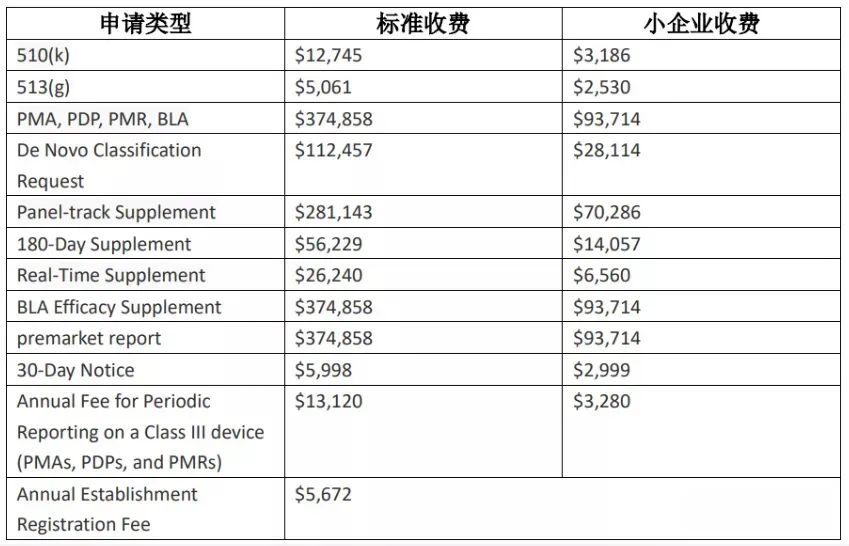
注:小规模企业收费,是指FDA认证为小企业资质的公司享受该优惠收费。* FDA小企业资质指的是公司最近税收年度的总收入或销售额未超过1亿美金,并需要提前1-2个月申请FDA小企业资质认证后才能享受优惠;
Small Business: This is defined as havinggross receipts or sales of no more than $100 million for the most recent taxyear. 2021年8月3日,欧盟医疗器械协调小组MDCG发布了SARS-CoV-2体外诊断器械的性能评估指南MDCG 2021-21。
该指南涉及在IVDD 98/79/EC或IVDR (EU) 2017/746下SARS-CoV-2 IVD产品的性能评估,覆盖了各类针对新冠的核酸检测试剂、抗原试剂以及抗体试剂的详细要求,如样本要求、接受标准等,如下表所示。制造商、公告机构、主管当局和授权代表等各利益相关方均可参考使用。

此外,该指南声称,其内容将构成IVDR下SARS-CoV-2 IVD产品通用规范CS的基础,CS将在未来几个月内被采用及实施。从新冠试剂制造商的角度而言,无论是为了依据现有的指令注册还是为D类认证做准备,都应尽早熟悉要求未雨绸缪。
▲向上滑动查看指南▲
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 