哪些医疗器械产品将被列入免临床目录?
工作机理明确、设计定型、生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
通过非临床评价能够证明该医疗器械安全、有效的;
通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的。
国家对“医疗器械免临床目录”实行动态管理,国家食品药品监督管理总局(CFDA)依据以上情况,不定期对免于进行临床试验的医疗器械目录进行制定、调整并公布。
就在今天,国家药品监督管理局发布了关于公布新修订免于进行临床试验医疗器械目录的通告(2018年第94号)。
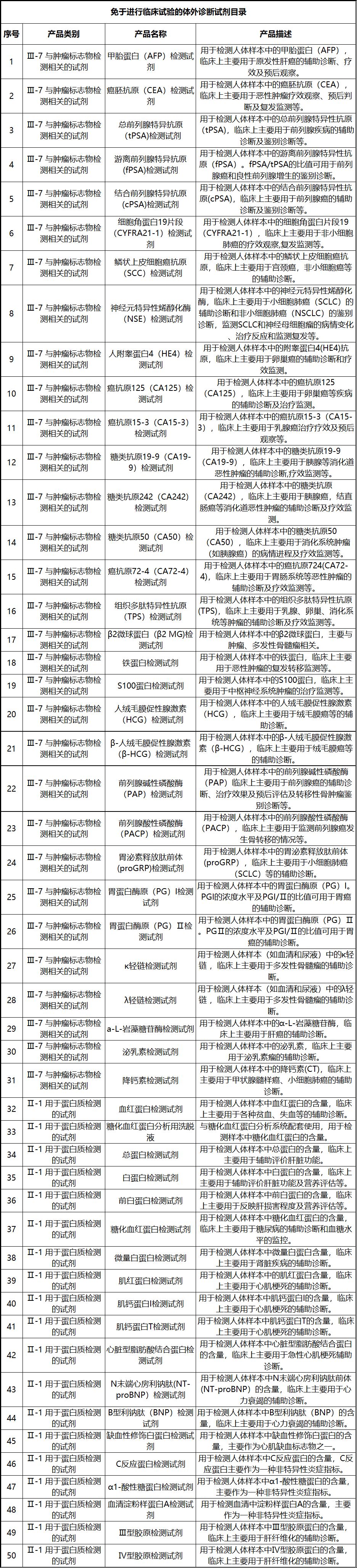
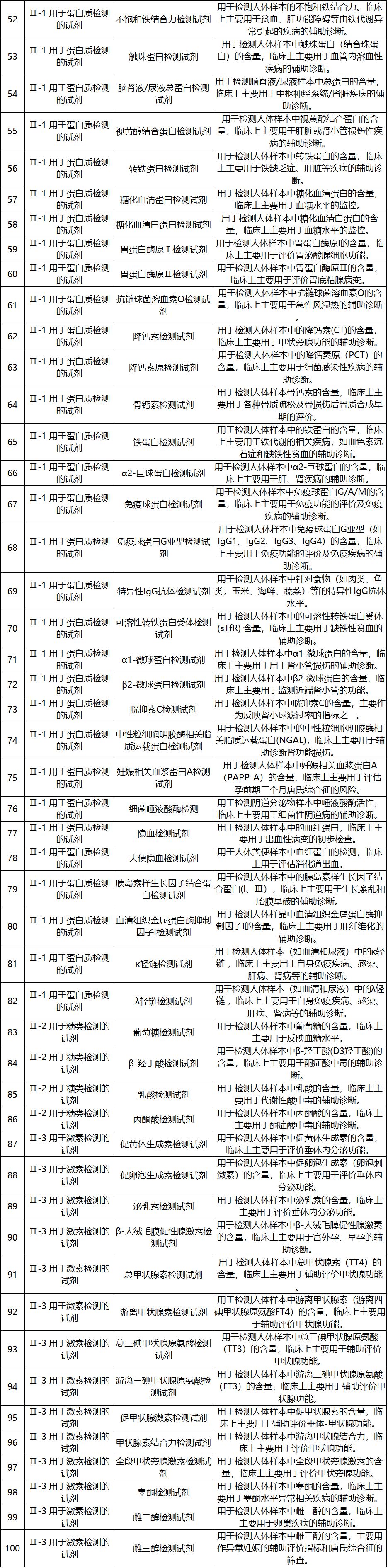
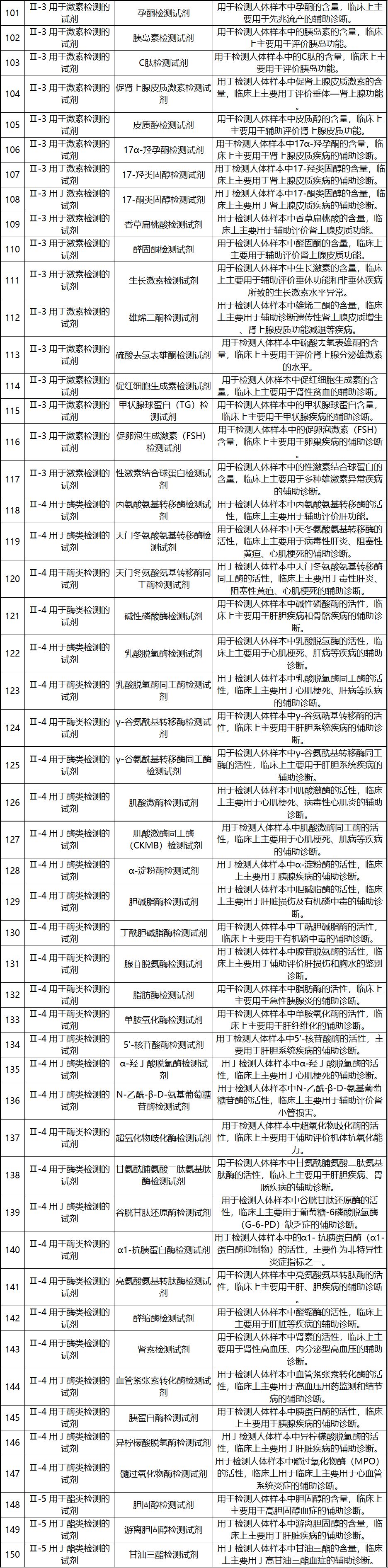
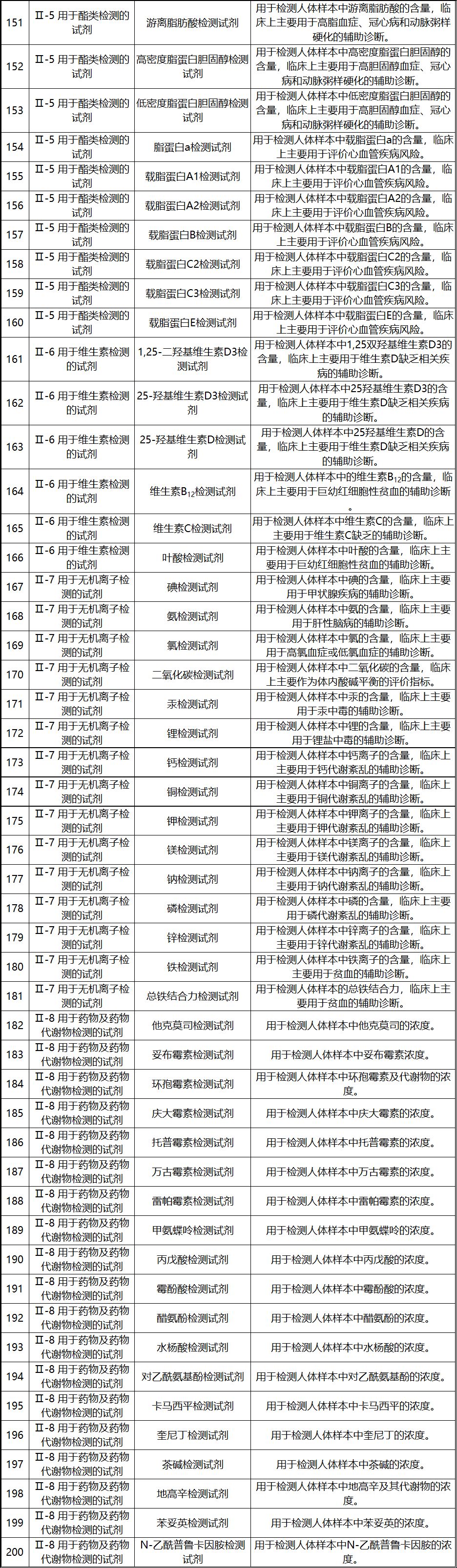
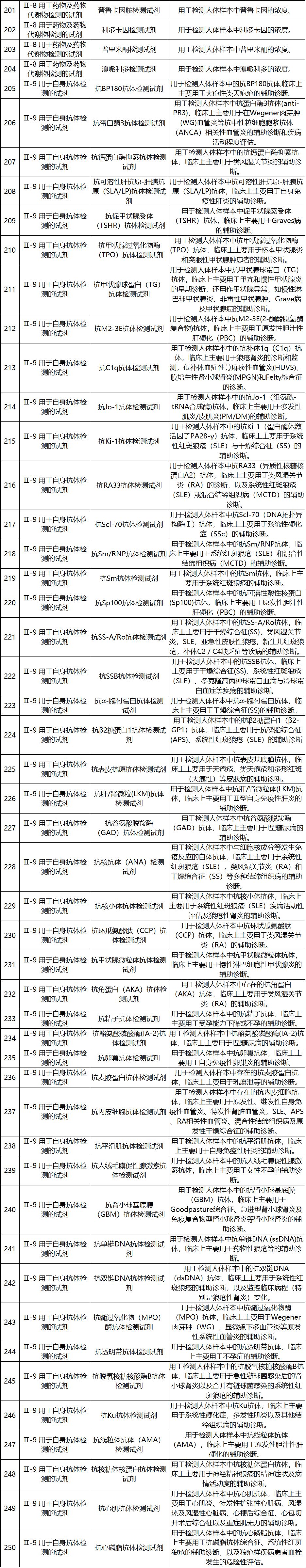
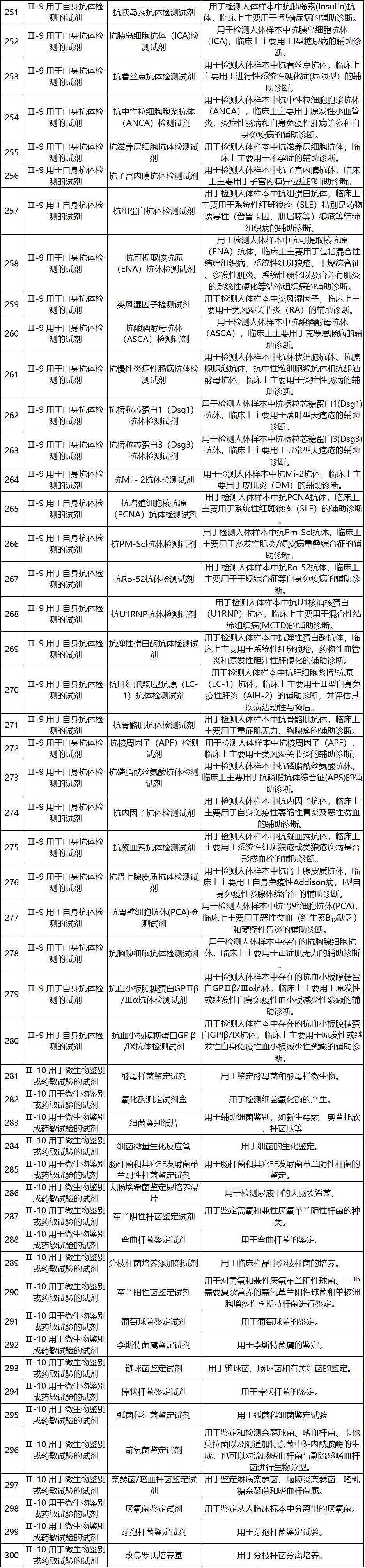
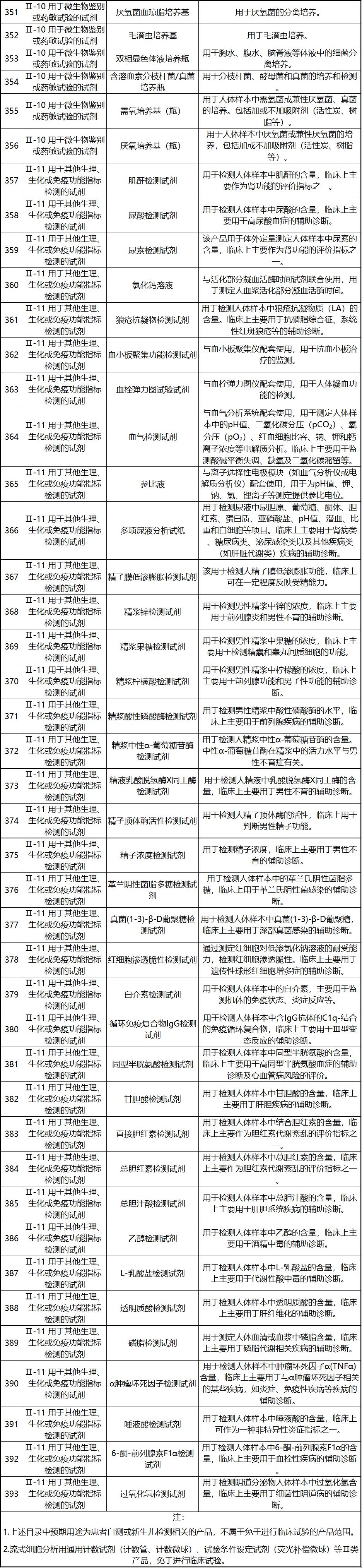
新《豁免目录》共包括免于进行临床试验的医疗器械1248项,分为“医疗器械产品”和“体外诊断试剂产品”两个部分,分别涵盖855项医疗器械产品和393项体外诊断试剂产品。较前三批豁免目录新增医疗器械产品84项,新增体外诊断试剂产品277项。
新《豁免目录》发布,再一次扩大了免于进行临床试验医疗器械产品范围,使我国在医疗器械临床试验方面的要求,进一步与国际接轨;降低了成熟度高、风险较低产品临床试验方面的要求,减轻了企业负担,使企业能将更多的精力投入到产品研发和质量提升上;也有利于进一步推进基于产品风险的临床评价方式,优化临床试验和审评审批资源,把宝贵的资源投入到临床急需和创新医疗器械产品上去,促进安全有效、风险可控的产品尽快上市,满足人民群众不断提高的用械需求。














 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


