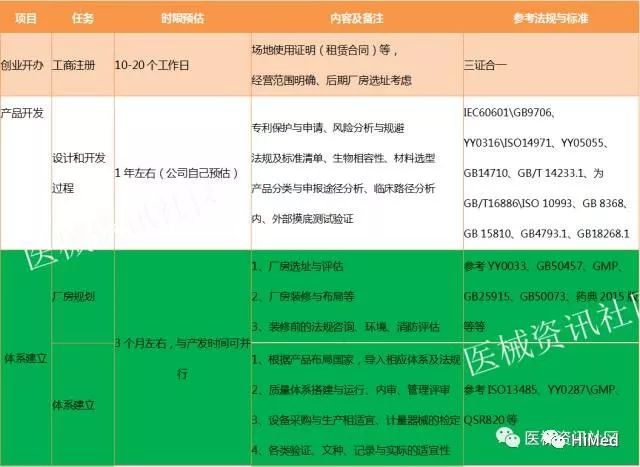
01 基本流程介绍
一个新开办的企业或创业者来讲,一款产品从无到走向市场,至少要经过产品开发、检测、临床、注册、生产许可等几个最漫长的阶段,而这些阶段都是没有产生利润和收益的,如何去评估这些阶段的风险?到底需要经历多少时间或周期?投入多少资金和成本?都是BOSS们最关心的问题。所以,今天笔者就整理了这样一篇文章,希望正准备进军医疗行业的BOSS们看完后心里有一点点底,笔者罗列了几个必经阶段:工商注册、产品开发、体系建立、创新产品申报(若涉及)、产品检测、临床、申报注册、生产许可、产品上市。下面就对每个阶段进行简单介绍。
2015年03月20日,李克强在国家工商总局企业注册局注册指导处考察提出,要加快三证合一登记的改革制度,如今,全国各地已纷纷执行。由工商行政管理部门(市场监督管理部门)核发加载法人和其他组织统一社会信用代码的营业执照,企业的组织机构代码证、税务登记证、社会保险登记证和统计登记证不再发放。
所谓“三证合一”,就是将营业执照、组织机构代码证和税务登记证三证合为一证。2015年10月1日就开始实行三证合一的政策,同时企业必须在2016年12月31日之前进行三证合一申请,过了这个时间以前的三证就无法使用了。
公司注册一定要注意:经营范围,考虑好将来生产的产品范围,不然后面又要做变更。而关于工商注册,前期自己办理也很简单,如果嫌比较麻烦,可以找一家比较不错的代理机构代办比较省事,也花不了多少钱。公司注册后,接下来就是产品开发。
一般来讲,既然创办公司,一定有了科研成果或产品布局,或者已具备了研发团队、方案、合作商等,不管怎样,对于新创办公司来讲,这都是一个非常艰难的阶段,因为会涉及大量的资金注入,技术的攻坚等,时间难以预估,也许是几个月、一年、两年,甚至更长。
对于新办企业来讲,如何在这个阶段降低风险、压低成本、提升速度,技术层面就是要有专业的研发团队,从法规角度来讲,建议公司咨询专业法规人员对产品开发进行风险评估、正确采标,并明确产品的申报途径等。
其实我们经常发现,很多新办企业在产品已经定型、开模后,才开始引进法规人员或寻找咨询机构,此时的所有建议和措施都是基于补救,严重的可能涉及改模、重新设计等,所以,对于新办企业来讲,这样的拆腾真的伤不起。
产品开发过程中,涉及的产品专利及侵权等方面,公司应重点进行控制他保护,同时考虑核心技术的转让、购买等问题,而产品的专利申报可以委托机构,后期如果涉及专利较多,可以招有经验的人兼职或专职。
如果产品为创新型,则应开始着手产品申报,走创新审批程序,由于国内法规不比以往,对于注册的专业知识越来越强,所以,建议公司在这个阶段招聘法规人员,由于目前很多从事法规工作的资深人士不单熟悉产品注册,而且还熟悉体系,所以,考虑到后面的体系建立,可以招聘比较全面的法规人员,虽然单人工资会高,但从体系、注册两个岗位两个人来考量比较,是非常合算的。
根据《医疗器械监督管理条例》、《医疗器械监生产质量管理规范》第64号法规要求,公司应建立质量管理体系,当然,如果公司不做国内市场,只做国外的,则根据相关的国家法规要求进行。而新公司面临两个方面,一是厂房、二是体系建立。
对于厂房,则需要根据产品管理类别和分类进行考量,如果是无菌、体外诊断类产品,则应严格按照法规和标准选址,远离有污染的空气和水(如远离铁离、码头、机场、交通要道以及散发大量粉尘、屠宰场、染料等)。厂房确定后,接下来就是装修、布局,如果是无菌类产品,对厂房的设计和装修,必须请专业的团队和公司来设计和施工,如行政区、生活区和辅助区不得相互防碍影响,空气洁净级别不同的洁净室(区)之间的静压差应大于5帕,洁净室(区)与室外大气的静压差应大于10帕,空气洁净度级别进行合理布局,人流、物流走向应当合理,避免交叉污染,注意洁净室的水池或地漏等。虽然委托给了专业的公司来做,但这整个过程,都需要有非常专业的体系人员进一步把关,否则,很容易被再次整改,比如消防、环评等通不过。
体系需要有专业的体系人员来负责,如果光靠完全不熟的人来做,弄一套模版就开始改加公司LOGO,编号,然后转化成公司的文件,其风险非常之大,如果体考不通过,则面临退审,如果整改花掉几个月时间,公司损失则不言而明,所以,新办企业要么招聘专业的体系人员,要么找专业的人士进行辅导,但从长远来看,公司宁愿招人,风险更低一些。
建立体系就涉及到一个新公司到底需要多少人的问题?哪些岗位不可以兼任?那么我们就来大概分配一下人员:
必备岗位人员:
生产负责人1名
研发部负责人1名
质量负责人1名
专职检验员2名
总经理1名
可兼任岗位人员:
管理者代表1名,可由质量负责人兼任
采购部负责人1名,可由研发老大兼任
销售部负责人1名,可由产品经理或总经理兼任
行政部负责人1名,也可让总经理兼任
内审员2名,持有内审资格证的即可兼任,但2人不得在同部门
生产人员1名以上
算下来10多个岗位,兼任下来,至少有6人以上,《医疗器械生产质量管理规范》及相关附录有这样一条,“企业应当配备与生产产品相适应的专业技术人员、管理人员和操作人员,具有相应的质量检验机构或者专职检验人员的要求。要求生产负责人与质量负责人不得兼任,专职检验员也不要兼任”,虽然明确了三个岗位不得兼任,但也明确提到,应配备相适应的人员,所以还是应当根据产品配备充足的人员,避免被开出不合格。
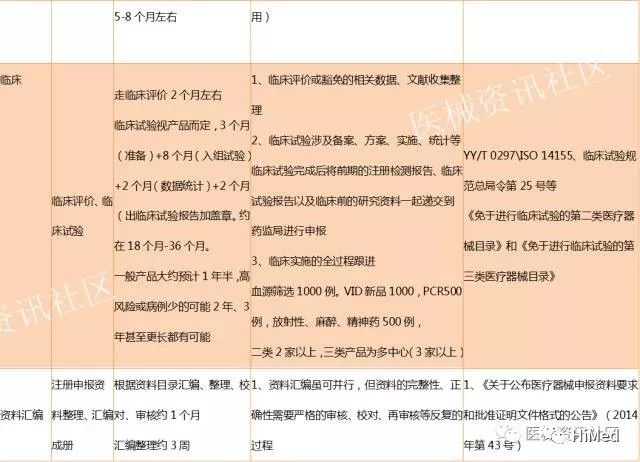
产品检测的样机应在符合GMP要求下生产的,以有源产品为例,型式检验分为性能测试、安规测试、EMC测试,如果接触患者还会涉及生物相容性测试,整个测试下来需要大约5-8个月左右,如果排队时间长或整改过程较长的话,可能还会延长一两个月,所以,一般情况下,为了顺利提高检测通过率,除了在送检之前的开发阶段就做好验证和测试,所谓摸底测试,而且还要重点了解检测所的服务情况,有些检测所的检测速度慢、排队长,有的检测所好沟通,检测时间相对会快一些。
耗时多的基本上都是EMC,所以前面讲到,为什么在开发立项和开发过程中就需要有法规人员进行评审呢,就是帮助研发工程师们在设计的时候就能清楚的告诉其遵循的标准和法规要求,降低后期的整改难度。
首次型式检测是免费的,但如果需要加快速度,可以申请加急,加急和整改后重检的收费 根据当地检测所收费要求进行,咨询一下就知道了。
一般在产品开发和立项的时候,就应该清楚产品的临床路径,是否走临床试验,查询豁免目录清单即可。
2014年08月21日 发布国家食品药品监督管理总局关于发布免于进行临床试验的第二类医疗器械录的通告(2014年第12号)2014年10月1日起施行
2014年08月21日 发布国家食品药品监督管理总局关于发布免于进行临床试验的第三类医疗器械目录的通告(2014年第13号)2014年10月1日起施行
2016年09月30日发布总局关于发布第二批免于进行临床试验医疗器械目录的通告(2016年第133号)并于2016年09月30日实施
2016年09月30日 发布总局关于发布第二批免于进行临床试验医疗器械目录的通告(2016年第133号)于2016年09月30日 实施
如果不在目录内,则通过临床试验或临床评价两个径途,对于新公司第一款产品,建议做临床试验,因为,一方面是很难拿到经验数据和对比资料的授权,第二方面是因为第一款产品出来后很快就会衍生第二款产品,第二款产品的临床就比较容易。
关于临床这部份,对于新公司来讲,建议找第三方有实力、专业的CRO,这样才能更快推进临床的整个进度。














 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


