电子通用技术文件 (electronic Common Technical Document, eCTD)是电子化的CTD注册申报方式,相对于传统的纸质递交,eCTD电子递交更便捷、更环保。从2008年起,FDA开始鼓励以eCTD格式提交相关新药申请材料。 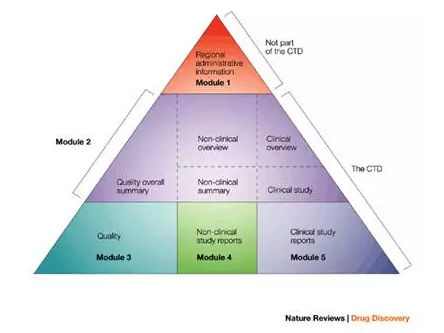 2015年5月5日,FDA正式宣布,到2017年5月5日前,NDA、ANDA、BLA和药物主文件(Master Files)申请必须采用eCTD提交。商业用药的临床研究申请 (INDs)可放缓至2018年5月5日。非商业用药的临床申请则不在此要求之列。 2016年11月7日,FDA对于eCTD申报提出了新的要求。对于在2016年12月17号后开展的临床研究和非临床研究,FDA要求其所有的NDA、BLA和ANDA申请均需符合FDA发布的数据标准目录(Data Standards Catalog),对于商业性IND,该要求生效日期为2017年12月17日。在截止日期之前,相应的技术拒绝标准(Technical Rejection Criteria)将被添加到现有的电子通用技术文档(eCTD)验证执行标准中。 在新的要求生效之前,FDA将会提前一个月在eCTD网站进行通知。如果新的电子申请不符合FDA数据标准目录的要求,FDA有权对NDA、BLA 或者ANDA发布拒绝文件(拒收标准见附表) 以下类型申请在向FDA递交时,必须符合FDA发布的数据标准目录(Data Standards Catalog):
另外一项需要注意的是,不管是在2016年12月17日之前还是之后开展的研究,均需提交试验摘要数据集(Trial Summary dataset)。 以下是需要进行研究数据验证的eCTD章节: • 4.2 Study Reports • 5.3 Clinical Study Reports and Related Information 以下eCTD章节不需要进行研究数据验证 • 4.2.1 Pharmacology • 4.2.2 Pharmacokinetics • 4.2.3.3 Genotoxicity • 4.2.3.5 Reproductive and Developmental Toxicity • 4.2.3.6 Local Tolerance • 4.2.3.7 Other Toxicity Studies • 4.3 Literature References • 5.3.1.4 Reports of Bioanalytical and Analytical Methods for Human Studies • 5.3.5.3 Reports of Analyses of Data from More than One Study • 5.3.5.4 Other Study Reports and Related Information • 5.3.6 Reports of Postmarketing Experience 附表1:eCTD 研究数据拒收标准 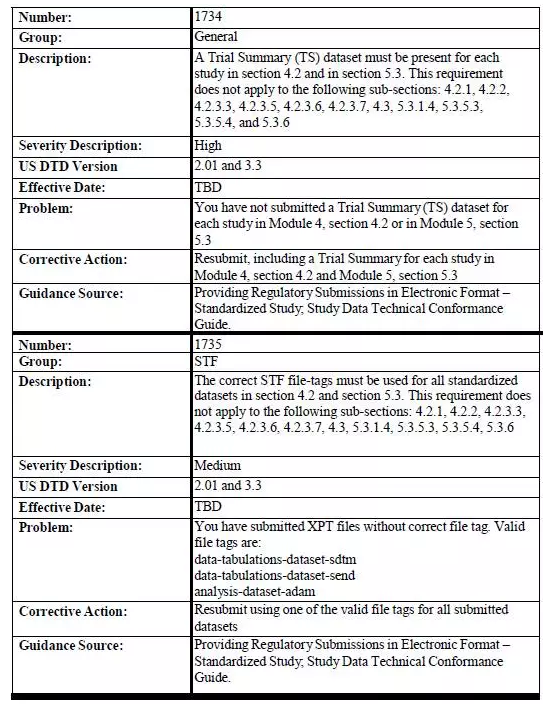 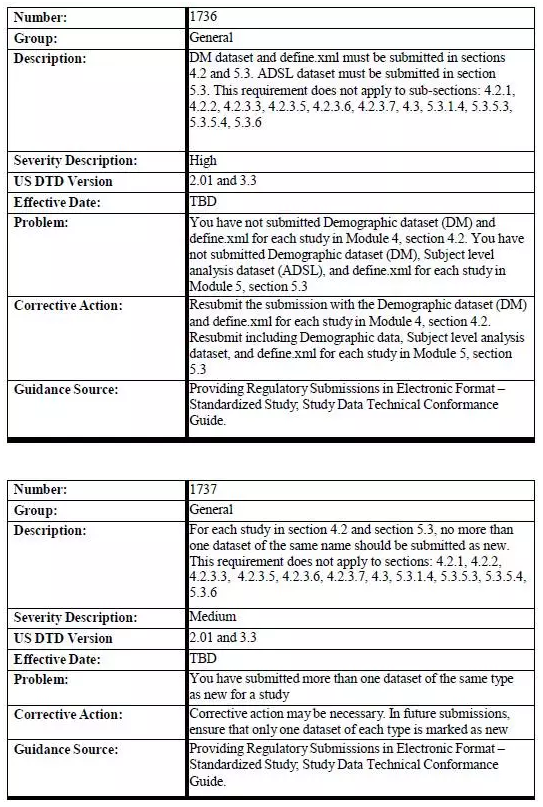 |
 /3
/3 