IVD仪器和试剂,这两种东西,研发差异有哪些?有多大呢?黄工试着回答这个问题。从12个角度,探究两者区别:底层技术学科、技术方向、产业链结构、原材料和零部件、研发架构、产品分类、产品构成和形态、生产工艺、技术平台、性能指标、监管法规、上市周期。仪器偏工科,试剂偏理科。根据《中华人民共和国学科分类与代码简表(国家标准GBT_13745-2009) 》,国家共设62个一级学科、676个二级学科或学科群、2382个三级学科。仪器研发,总体需要工学人才。试剂研发,总体需要理学人才。下图所列,是IVD研发涉及的一级学科。仪器研发,主要涉及:电子技术、计算机技术、传感器技术、信号处理技术、机械制造与自动化、光学工程、自动控制、流体力学、自动化、软件工程、生物医学工程、统计学、材料学、通信工程、精密仪器、管理科学、机电工程、工业设计等专业。试剂研发,主要涉及:细胞生物学、病毒学、基因工程学、发酵工程学、免疫学、分子生物学、临床检验学、微生物学、生物化学、血液学、基因组学、植物学、药学、酶学、生物信息学、有机化学和材料学、遗传学等专业。
技术方向差异
基于底层学科,进一步延展至技术方向。左侧为仪器研发技术方向,这些方向进一步发展,就是各类的工程师了。比如,机械工程师、电子工程师等。右侧为试剂研发技术方向,进一步延伸就是试剂系列,或IVD的细分赛道。在实际中,会比下图列举更复杂。
产业链结构差异
讲起产业链,就要复杂一些了。产业链,其实是和第4点:原材料和零部件,联系在一起的。我们站在中游:生产企业,去看上游及其上游:生物原料和仪器元件,还有下游:检测服务,与终端用户紧密相连。讲产业链,得追溯至自然资源层面,就是最原始的资源。画此简图的意义,在于了解IVD仪器和试剂的差异,以及从最原始物质到医院医疗机构使用的产品,期间经历了几百道工序流程,涉及几十上百万家企业参与,这流程是非常漫长的。零部件和原材料的采购,会受更上游行业的影响,只不过价格和供应的传导机制,也是比较漫长而已。下图其实也可以命名为,IVD原材料供应链系统。从系统视角,去探查IVD产品的来由。也是想说明一件事:IVD研发,是一件非常复杂的系统工程,所涉环节、流程、人员非常多,任一单一子系统会影响整体系统功能,但并非都是决定性的。

原材料差异
- 机械零部件:①直线运动零件(无油衬套、手动位移台、直线导轨、拖链、轴承、关节轴承、直线电机、滚珠丝杠、支座组件),②传动零件(联轴器、同步带、同步轮、平皮带、圆皮带、滚轮、齿轮、齿条、链轮、链条、万向节和同步带压块),③气动元件(气源处理元件、真空发生器、真空压力开关、气动接头、调速阀类、气缸、控制阀、真空吸盘、气管软管),④铝型材及配件(铝合金型材及配件),⑤工业框体结构部件(手轮、拉手、门锁、滑轨、门部件、手柄、脚杯、铰链、脚轮、把手等,⑥机械加工件(连接块、检验夹具、转轴、导向轴、固定环、标准治具、支柱、底座、导向轴支座、定位零件、导向零件、悬臂销、铰链销等),⑦机械标准零件(弹簧、氮气弹簧、密封圈、磁铁、螺丝、螺帽、垫圈、轴环等),⑧其他(工业用材料、检测用零件)。
电子元器件:电阻、电容、电感、电位器、电子管、散热器、机电元件、连接器、半导体分立器件、电声器件、激光器件、电子显示器件、光电器件、传感器、电源、开关、微特电机、电子变压器、继电器、印制电路板、集成电路、各类电路、压电、晶体、陶瓷磁性材料、印刷电路用基材基板、电子功能工艺专用材料、电子胶(带)制品、电子化学材料及部品等,计算机芯片、存储芯片、电源芯片等。
电气元件:断路器、交流接触器、中间继电器、指示灯、接触器、热继电器、转换开关和行程开关、熔断器、按钮、指示灯、端子、节点、万能转换开关、行程开关等、线束等。
光学元件:激光器、滤光片、物镜、透镜、凹面平像场光栅、光电探测器、鞘流池、玻璃比色杯、棱镜、反射镜、LED、氙灯、聚光镜等。
流体零部件:采样针、穿刺针、清洗针、搅拌针、加热针,柱塞泵、注射泵、移液泵、无阀泵,电磁阀、分血阀、旋转阀、夹管阀、高压阀,冷凝器、散热器,卡环管、软管、翻边管、硬管、快插接头、单向阀、过滤器、平底接头、螺纹垫片、卡箍等。
(2)IVD试剂原材料:
(以下资料,来源于《中国体外诊断产业发展蓝皮书2019-2020年卷》)
①按照反应体系分类
②按应用领域分类
生化诊断原料:酶(乳酸脱氢酶、肌酐酶、胆固醇氧化酶、酮氨氧化酶等59个品种),辅酶(NAD、NADH、NADP、NADPH、CoA、Thio-NAD等20种),底物(Glupa-C、Gal-G2-GNP、EPS、CNP-AFU等9种)、抗原抗体(C反应蛋白多抗、肌红蛋白多抗、D-二聚体单抗等常用30多种),胶乳等
免疫诊断原料:核心是抗原抗体(感染类、心肌标志物类、肿瘤标志物类、激素类、自免抗原等),碱性磷酸酶、辣根过氧化酶,发光底物(APS-5、AMPPD、鲁米诺等),微球
分子诊断原料:前处理酶(蛋白酶K),核心酶原料(Taq DNA聚合酶、逆转录酶、UDG酶等100多种),PCR、RT-PCR预混液,dNTP等5种脱氧核糖核苷酸,NGS原料(T4连接酶、Klenow片段、Tn5转座酶等10余种),探针引物,磁珠
凝血诊断原料:S2238、凝血因子、巴曲酶等常用30多种
生物传感器酶:葡萄糖氧化酶、葡萄糖脱氢酶、尿酸酶等19种,底物(乳酸、胆碱等)
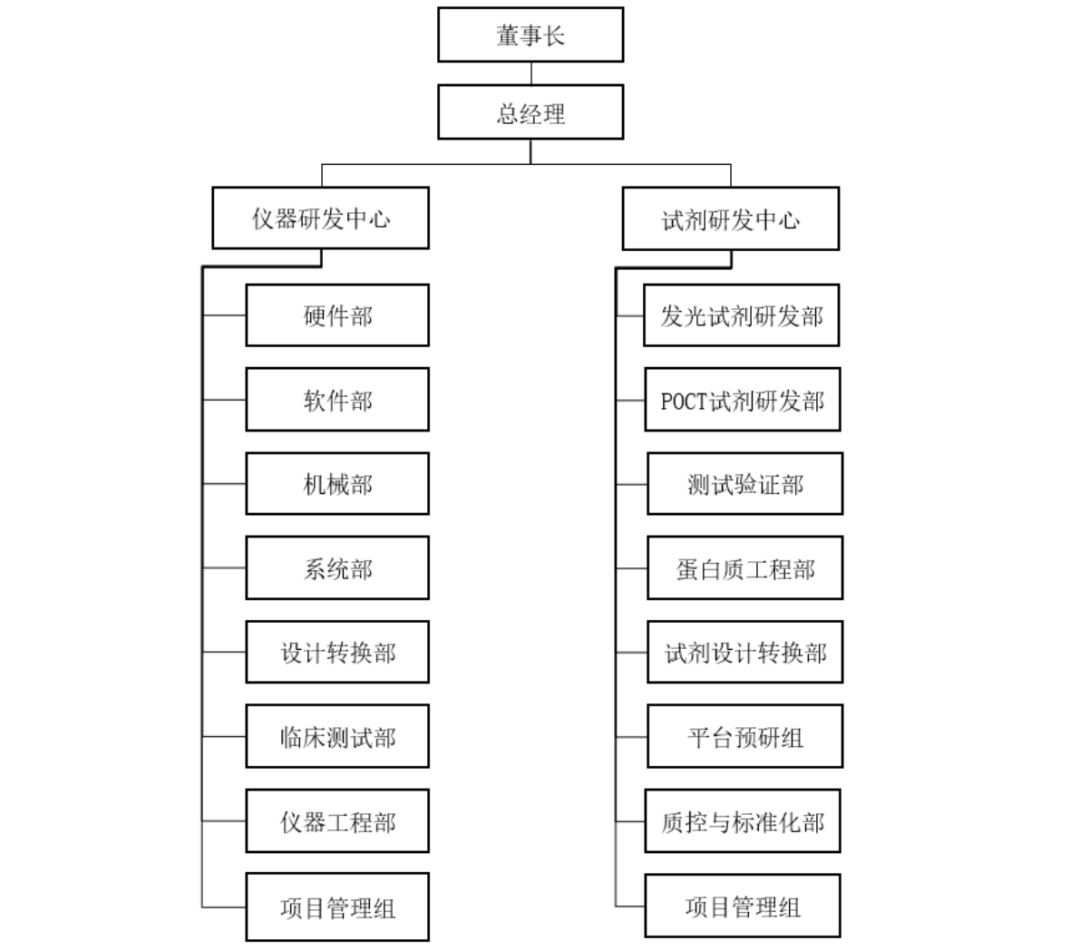
IVD仪器和试剂的分类,是有很大差异的。IVD仪器分类,是根据《医疗器械分类目录(2017年第104号)》。而试剂分类,则是根据《体外诊断试剂分类规则(2021年第129号)》。根据试剂分类规则,试剂按个人风险或公共健康管理风险,可分成三类。第三类等级最高。另外,今年3月,国家药监局官网发布,《体外诊断试剂分类目录(修订草案)》(征求意见稿)。该草案所展示的试剂分类达2045种。其中,Ⅲ类试剂402种,占比19.66%;Ⅱ类试剂759种,占比37.11%;I类试剂885种,占比43.27%。IVD仪器和试剂的构造和组成,大概分成以下部分。仪器属于固体,设计、生产、组装环境要考虑,温湿度、洁净度、照度、辐射、防静电、振动、电磁干扰等因素。运输过程,需要使用硬质木箱包装,长拖车进行运输,保证无损。IVD仪器重量,少则几十KG,多则几百上千KG。涉及的元器件、零部件,也达几千上万个,迈瑞太行流水线有6万个。试剂属于液体,需要瓶瓶罐罐盛放,也有保质期和温度要求。运输过程,要用到冷藏冷链车。生产厂房要符合生产质量规范,洁净无菌、防止静电等等。生产试剂用的工艺用水一般为纯化水,需要经过过滤装置过滤。IVD仪器和试剂研发,一般来说分属两个研发中心,由两位总监分管。这里借用亚辉龙的研发架构,说明问题。仪器研发中心,负责体外诊断仪器的研发、技术转换及临床试验,下设硬件、软件、机械、系统、设计转换及临床试验等部门。试剂研发中心,负责体外诊断试剂的研发、技术转换及临床试验,下设化学发光研发部、POCT 试剂研发部、蛋白质工程部、试剂设计转换部、测试验证部、平台预研组、质控与标准化部、项目管理组等部门。

对于技术平台,一般的企业会分成三类。试剂、仪器和原料。有些企业,会将技术平台分成试剂仪器原料。有些会当成产品平台对待。在这个技术平台上,可以开发仪器、试剂。具体如何定义,各家企业都不同。得看企业内部定义后,才更加清晰。下图只是随机列举四家企业的技术平台,可以相互比较看看。IVD仪器和试剂的性能指标。仪器性能指标,主要有三类:分析性能指标、电气安全指标、电磁兼容指标。试剂性能指标,主要有两类:分析性能指标、临床性能指标。
(1)IVD仪器生产流程
一般会经历,生产领料,对仪器元件、零部件等物料,进行质量检查。然后进行组件装配,机架安装、布线、布管,再进行整机组装。组装完成后,对仪器功能进行检查调试,再对仪器进行整机测试、性能测试、老化测试等等。测试通过后,进行外壳安装、整机检查,全部合格后打包入库,等待出货。
(上图来源:嘉兴凯实招股书)
(2)试剂生产流程
(以下资料来源:2022体外诊断科技创新发展报告)
化学发光试剂生产,包括包被反应板、标记物制备、各种溶液的配置、冻干、分包装等步骤,并通过产品的半成品检验和成品检验两个质控过程,来保证其质量符合规定。
监管法规差异
但是,试剂比较特殊。其还将受到《体外诊断试剂注册与备案管理办法》《体外诊断试剂分类规则》的约束。这是试剂相较于其他医疗器械而言,单独的法规标准。其他医疗器械都属于固体,或者说是有源设备,它们之间监管的规则比较通用。而试剂属于液体,有两类检测试剂,用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂,甚至还按照药品的等级管理。一、二、三类,是根据产品风险等级划分,一类、二类到省药监局备案注册,三类到国家药监局(NMPA),医疗器械技术审评中心(CMDE)注册,即审评六部。这是《医疗器械监督管理条例》规定的。
仪器,三类至少3年,二类2年左右,一类1年左右。仪器上市周期,因产品和项目复杂程度,差异较大。若是大公司,前期有成熟产品线、技术平台和研发团队,研发推进会快一些。消耗时间较多的,是注册阶段。型检、整改、发补等,会来回折腾。
试剂,三类3~5年,二类2~3年,一类1年左右。而试剂上市周期,最消耗时间的,则是型检和临床。型检一般由注册部门负责。IVD大型企业,有自检资质的,可以自主进行。这是2021年10月发布的政策,资质由国家局、省局认可。
三类试剂,有些送到北京检验所,依托第三方验证。需将仪器和试剂打包送检。那三类试剂临床试验,一般也需要8-10个月,至少需要入组上千个病例。像一些小众的疾病,若一家医院病例不够,还需要反复协调,和更多医院增加入组。当然,也有捷径。国家药监局,制定了创新医疗器械特别审批程序,为一些技术创新性产品、急需上市产品,开通了绿色通道,极大缩短了上市周期。比如,近几年的新冠检测仪器和试剂,属于三类,按常规上市周期,至少3年。

— /3
/3 