《医疗器械生产质量管理规范》 第十章是销售和售后服务,体外诊断试剂、无菌医疗器械附录对该章节没有新增特殊要求。而在植入性医疗器械的GMP附录《2015.07.10 医疗器械生产质量管理规范附录植入性医疗器械》中“2.8 销售”下有个特殊要求条款:2.8.1 应当要求其代理商或经销商保存医疗器械分销记录以便追溯。企业应当保存货运包装收件人的名字和地址的记录。 
销售和售后服务的难点在于反馈和投诉,反馈和投诉涉及多部门之间的协调,需要相关部门重视,理解法规要求,客户要求,执行反馈和投诉的接收、分析、处理过程。销售和售后服务的重点在于反馈和投诉,通过客户的反馈和投诉,触发产品的功能迭代升级、产品的质量改进提升、产品的生产工艺和质量控制过程改进等。详细的投诉反馈处理过程和方法可参见《GBT 19012-2019 质量管理 顾客满意 组织投诉处理指南》。现有主流的几个质量管理体系监管法规/标准对销售和销售服务均有规定,美国FDA 的QSR 820和中国的GMP因为是强制性要求,对销售和售后服务规定更为细致,重点强调客户资质和产品资质,销售的可追溯性,对客户反馈投诉处理要求。 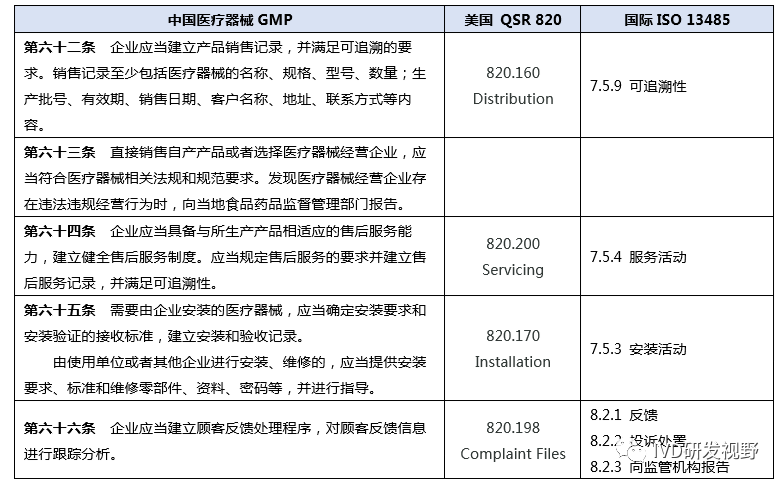
2.1《医疗器械生产质量管理规范现场检查指导原则》对销售和售后服务的检查方法如下: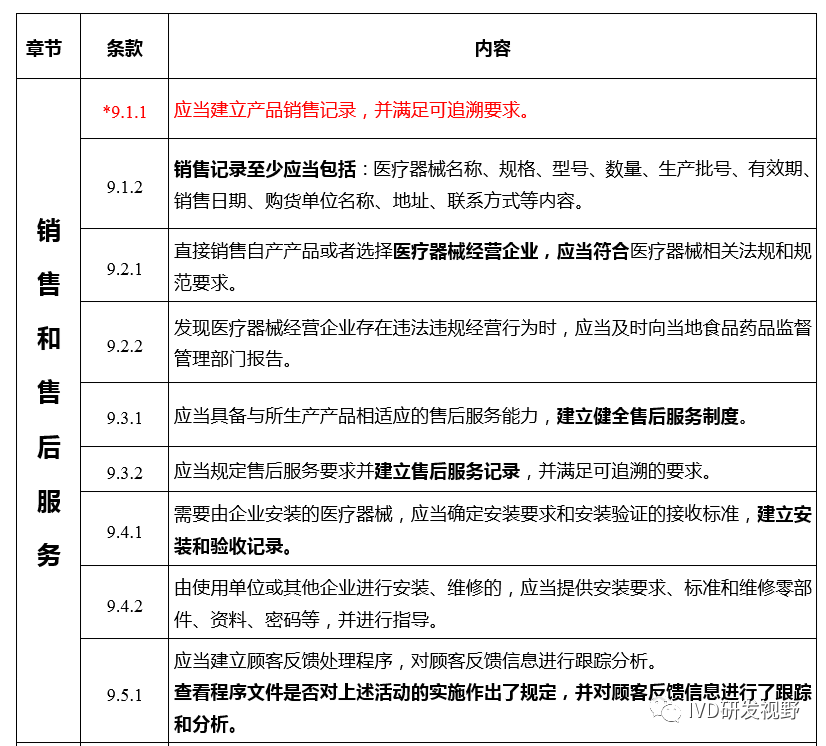
2.2根据FDA CFR 820.198,医疗器械制造商必须建立接收、审查和评估客户投诉的程序,保留所有客户投诉记录。客户投诉处理流程应确保及时处理投诉,在收到口头投诉时记录在案,当适用时按21 CFR 803部分要求向FDA报告(FDA希望看到所有在其管辖范围内使用和销售的医疗器械的投诉都得到适当的调查和报告。当投诉发生在美国以外地区,也需要上报)。当制造商接受FDA检查时,他们一定会关注厂家如何处理投诉。未能充分落实投诉程序是发出警告信的一个相对常见的原因。
2.3《GB/T 42061-2022/ISO 13485:2016 医疗器械质量管理体系 用于法规的要求》总要求和FDA CFR 820一致,仅在描述上有差别。

汇总分析国家局2016-2022年飞行检查中关于销售和售后服务的不符合项,可以看出关于销售和售后服务不符合项主要集中在几个方面: 
(一)经营资质问题
(二)销售记录问题
(三)售后服务问题 
(四)投诉反馈问题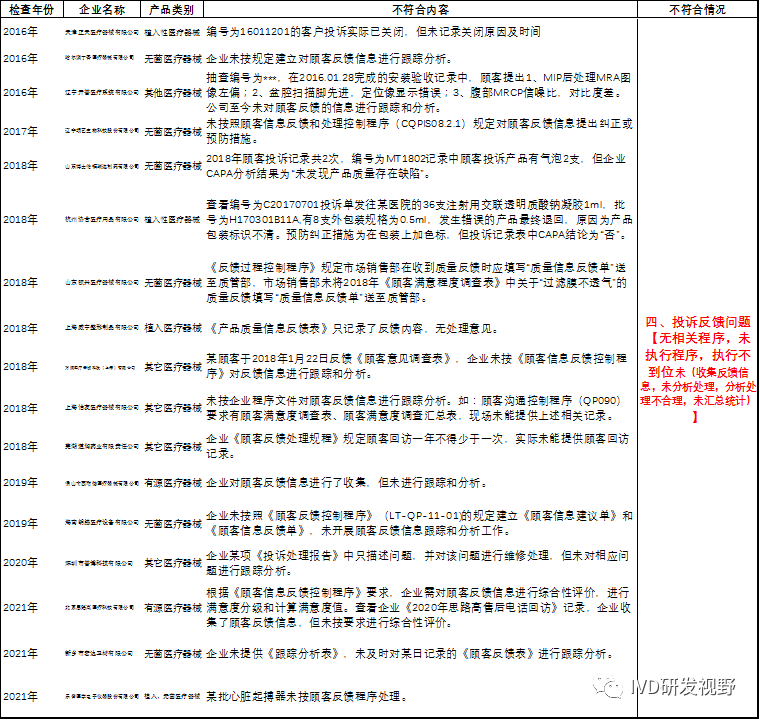
当我们听到反馈、投诉时,下意识是畏缩的,觉得这是坏事,不能拥有这些投诉,但换个角度来看,反馈投诉代表没有满足客户需求,如果把这些问题当作机会,作为学习机会和产品改进的机会,通过深究问题的根本原因,不但可以进当下产品,可能还可以改进系列产品。就如人无完人,产品也不可能完美,有些问题是可预测的,有些问题是非预期的,在特定条件和环境下暴露出来的,意味着风险无法完全消除,关键在于正视和积极处理问题。
|  /3
/3 