近日,美国BD公司宣布其BD Onclarity 具有扩展基因分型能力的HPV检测技术获得FDA上市前补充批准(PMA)。

BD Onclarity HPV Assay是采用BD Viper LT系统的一个的定性的自动检测采集在BD SurePath的宫颈标本中的HPV分子诊断技术。是一基于由PCR扩增HPV的靶区DNA并结合核酸杂交用一次性检测来检查14种高危HPV。该技术检测基因型16、18、45,并同时检测其他的高危HPV包括31、33、35、39、51、52、56、58、59、66和68。
本批准包括BD Onclarity HPV检测在基于细胞学的筛查中使用ASC-US(不确定显著性的非典型鳞状细胞)分诊、联合检测范式和原发性HPV筛查。
研究者表示,采用同时进行基因分型的人乳头瘤病毒(HPV)检测的筛查策略,通过允许筛查样本上已有的风险分层,为改善宫颈癌筛查提供了一种非常简单的方法。据悉,BD Onclarity HPV测定法是唯一经FDA批准的可单独鉴定和报告14种高危HPV基因型的测定法。 截止到2020年7月,美国FDA共批准了5家公司拿到了宫颈癌相关高危型HPV检测。有Hybrid Capture 2,Cervista HPV,Cobas HPV,Aptima HPV和BD Onclarity HPV Assay。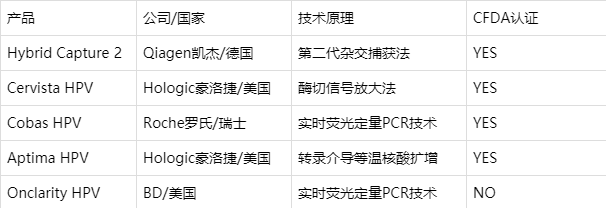
非Hybrid Capture 2简称HC2,于1997年由Digene公司开发,是FDA 最早批准用于诊断HPV的方法,在HPV检测领域作为“金标准”。HC2-HPV-DNA的技术原理是第二代杂交捕获,本质上是采用RNA探针进行靶标捕获,利用抗体和酶进行信号放大,与现在大热的化学发光具有异曲同工之妙。利用传统的微孔板,该法可定量检测13种高危型HPV DNA (16、18、31、33、35、39、45、51、52、56、58、59、68)Cervista HPV由Hologic豪洛捷/美国于2009年3月12日经FDA批准。Cervista HPV采用的方法是酶切信号放大法,该法与HC2的特点也是不需要扩增。与HC2采用化学发光进行信号放大不同,Cervista HPV由Cleavase酶特异性识别并切割目标DNA分子结构,通过识别目标DNA与信号放大两个步骤,直接检测特定核苷酸序列。
Cobas HPV Cobas 4800 HPV检测技术是罗氏公司于2009年11月在欧洲市场推出的。2011年4月,美国FDA批准Cobas 4800 HPV技术用于宫颈标本的检测。罗氏作为全球顶尖的制药和诊断技术公司,其HPV DNA诊断技术依托其强大的自动化诊断平台Cobas 4800,采用荧光定量PCR技术进行HPV检测。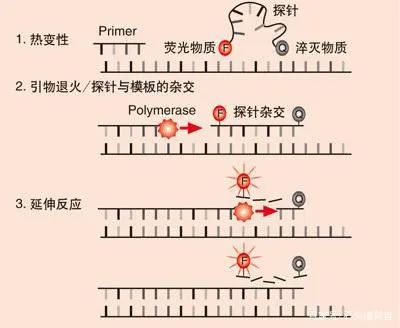
Aptima HPV最早由Gen-Probe公司研发,后来于2012年8月被Hologic收购。FDA在2011年10月28日批准用于HPV检测的全自动分子诊断检测系统,也是最早的HPV E6/E7 mRNA 检测系统。Aptima HPV所采用的技术是转录介导等温核酸扩增,具体原理如图所示。转录介导的扩增技术可以RNA为模板,利用RNA聚合酶和逆转录酶在约42 oC等温反应条件下进行扩增,产物为RNA。该技术在每一循环可产生模板的100-1000个拷贝转录本。检测HPV E6、E7 mRNA被称为第二代HPV检测技术。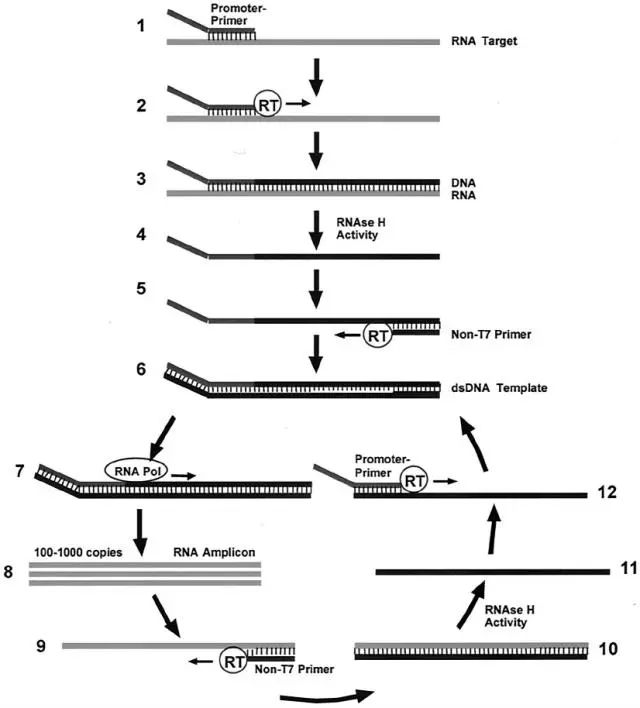
BD Onclarity HPV Assay HPV检测技术由美国BD公司(Becton, Dickinson and Company)研发,是于2018年2月12日由FDA批准的最新HPV检测方法。该方法主要依托BD Viper LT系统,系统内部集成了核酸提取,扩增和检测,能自动进行样品处理、核酸提取、即时聚合酶链式反应(RT-PCR)扩增检测以及结果报告,将最小化降低人为干预。所采用的技术原理主要是实时荧光定量PCR。与罗氏的产品不同,Onclarity 也是以HPV E6、E7 DNA作为靶点进行HPV检测,能一次性检测14种高危HPV(16,18,45,31,33,35,39,51,52,56,58,59,66和68)。 |  /3
/3 