前情提要
截止1月30日下午1:00,我国新型冠状病毒确诊病例7742例,疑似病例12167例,死亡人数170例,治愈人数131例。值得一提的是,在本次疫情中,被称为“最后的净土”西藏也出现了疑似病例,后经西藏疾控中心进行检测后,确诊为西藏首例新型冠状病毒感染患者。目前,为公众实时披露疫情状况的数据版“中国地图”已通红一片。
1月29日,中国疾控中心流行病学首席科学家曾光做客人民日报客户端时表示:“疫情拐点将出现,期待正月十五有明显成效”;同一天内,中国科学院把武汉病毒研究所表示:已筛选出能在细胞层面较好抑制“2019-nCoV”的药物,具有潜在临床应用价值”
1月28日,继之江生物、捷诺生物、华大基因、华大智造检测产品获得优先审批后,达安基因、圣湘生物的2019ncov试剂盒获批上市!值得一提的是,国家药监局仅仅用了8天时间审核过了6家IVD企业产品。显而易见,特殊时期,特事特办的国家速度如此之快。
央视报道:国药监局“急速”审批
1月27日,据央视网报道,药监局已要求省级药监部门加强对核酸检测试剂产品生产企业的监督检查,确保产品质量安全。国家药监局将继续对疫情防控所需药品医疗器械,采取特殊审批程序,争取相关产品尽快上市。
(图片来源:央视新闻 )
众所周知,这次疫情的爆发地点起始武汉华南海鲜市场,进而快速蔓延至湖北全省乃至全国。到目前为止,我国绝大多数人群对传染源、传染途径、检测手段、预防措施、预测“拐点”时期等信息都有一定的了解,小编不多赘述了。
今天我们主要从企业资质、产品性能、技术手段、产能等方面对这6家已被审批通过“2019ncov”试剂盒企业进行不同维度的分析。
截止到1月30日 21:00,共计91家IVD企业研发出了新型冠状病毒核酸检测试剂盒,但是目前被药监局快速审批的只有这6家,对于后续其他IVD企业生产的2019ncov试剂盒国药监局仍在快速检查、审核中。
那么,为何仅在8天时间内,国药监局审批了这6家企业生产的“2019-nCoV核酸试剂盒呢?它们是否在产品灵敏性、检测速度、质量等方面“快人一步”呢?
6家获批“2019-nCoV”试剂企业大比拼!
圣湘生物—国械注准20203400064
圣湘生物科技股份有限公司是以分子诊断和基因检测技术为核心,集医疗诊断试剂、仪器、第三方医学检验服务为一体的整体解决方案提供商。
1月28日,圣湘生物新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)通过国家药品监督管理局审批,获得医疗器械注册证书。
产品特点:
该项目研究得到了科技部应急专项支持,产品采用圣湘生物独创的“RNA一步法”技术,可适用于不同应用场景,操作简单,检测耗时短,灵敏度200copies/mL,全程内源性管家基因监控,样本处理与扩增检测在一个PCR反应管中即可完成,最大程度减少生物安全风险和交叉污染。
该产品通过简单的样本处理后可直接在常规荧光PCR仪上使用,1个操作人员在2小时内(前处理仅需10分钟)可以完成96份样本的检测;结合圣湘生物自主研发的全自动核酸提取仪,单批检测样本量可达96人份,能实现1人1机1日检测样本量达1000人份以上的高通量检测;结合圣湘生物移动分子诊断平台,实现现场即时检测。
产能:
面对突发疫情应急物资短缺的需求,公司春节假期紧急调配员工返岗,组织研发生产,所有生产线满负荷工作,新型冠状病毒核酸检测试剂日均产能最高可达50万人份。
新型冠状病毒感染的肺炎疫情刚开始在武汉发生时,圣湘生物便成立了以国家特聘专家、中国体外诊断领军人物戴立忠博士领衔的疫情防控应急技术攻关小组,联合军事科学院军事医学研究院,并基于公司10余年的技术沉淀和数亿人份产品应用积累经验,于1月14日成功研制出新型冠状病毒核酸检测试剂盒。
值得一提的是,圣湘生物开发的高精度“磁珠法”、国际领先的快速简便“一步法”和通用型“全自动统一样本处理”、全球最快之一的“POCT移动分子诊断”等一系列核心技术,获国家科技进步二等奖。
其中,磁珠法系列的产品以其超高的灵敏度填补了国内核酸检测技术的空白。
达安基因—国械注准20203400063
中山大学达安基因股份有限公司依托中山大学雄厚的科研平台, 是以分子诊断技术为主导的,集临床检验试剂和仪器的研发、生产、销售以及全国连锁医学独立实验室临床检验服务为一体的生物医药高科技企业。公司于2004 年8 月在深圳证券交易所挂牌上市,成为广东省高校校办产业中第一家上市公司。
产品特点:
新型冠状病毒试剂结构及组成/主要组成成分为NC(ORF1ab/N)PCR反应液A、NC(ORF1ab/N)PCR反应液B、NC(ORF1ab/N)阴性质控品、NC(ORF1ab/N)阳性质控品。适用范围/预期用途为,“本试剂盒用于体外定性检测新型冠状病毒感染的肺炎疑似病例、疑似聚集性病例患者、其他需要进行新型冠状病毒感染诊断或鉴别诊断者的咽拭子、痰液样本中。
获批的新型冠状病毒2019-nCoV核酸检测试剂盒(荧光探针法)可同时检测ORF1ab基因和N基因,并设计了内源性内标,可评估样本取样是否合格并能有效监控假阴性的出现,可辅助临床实现早诊断,早治疗。
产能:
该试剂盒的生产能力为20万人份/日,核心原材料均为达安基因所掌握,并根据需求产能迅速扩大到50万人份/日。
另外,达安基因拥有国际上首个荧光定量聚合酶链式反应(FQ-PCR)诊断试剂核心技术的自主知识产权为标志,在分子诊断技术及其产品的研制、开发和应用上处于国内前列。
颇有亮点的是,达安基因乙肝试剂盒是我国第一个正式批准临床应用的荧光PCR诊断试剂盒。
之江生物—国械注准20203400057
上海之江生物成立于2005年,是一家专业从事基因诊断产品的研发、生产、销售的高新技术企业,主营荧光定量PCR分子诊断试剂,也是国内分子诊断试剂生产的龙头企业之一。
1月24日,经过上海市医疗器械鉴定所的检验,之江生物成为我国首个获批新型冠状病毒核酸试剂盒企业。
产品特点:
之江生物这类检测试剂盒的科学原理名为“荧光PCR(聚合酶链式反应)法”。它是一种用于放大扩增特定DNA(脱氧核糖核酸)片段的分子生物学技术,能利用聚合酶链式反应将微量的DNA大幅扩增,从而检测出带有特定基因片段的病毒。
对似感染新型冠状病毒的患者,医院、疾控中心、出入境检验检疫局的工作人员将用荧光PCR试剂对他们的鼻咽拭纸、痰液、肺泡灌洗液3种样本进行检测,测定它们是否含有新型冠状病毒
之江生物快速成功研制出新型冠状病毒(2019-nCoV)检测试剂,一小时左右即可出具新型冠状病毒核酸检测结果,为疫情防控提供最快的结果判断。
产能:
据介绍,之江生物测试批次产能为20万人份,公司储备了100万人份产能
捷诺生物—国械注准20203400058
国药集团上海捷诺生物科技有限公司隶属于国药集团、中国生物,是中国生物qixia诊断试剂经营企业,专业代理销售国内外医疗器械和体外诊断试剂。
代理的产品涵盖分子诊断、微生物学、免疫学等领域,合作伙伴包括来自北美、欧洲、日本等国家的跨国公司和国内在专业领域享有盛誉的生产厂商。
1月26日,国药中国生物上海捷诺生物科技有限公司,取得了国家药品监督管理局颁发的第一批新型冠状病毒核酸检测试剂盒医疗器械注册证。
武汉不明原因肺炎事件发生后,中生捷诺立即投入研究开发,经过设计、优化和试验,首家成功研制出新型冠状病毒核酸检测试剂盒,并于第一时间送至中国疾控中心验证。接受到国家疾控中心的有关指令后,全力开启了生产模式,并在首批合格产品下线后,专供国家疾控中心、湖北省疾控和各省市疾控中心用于一线检测,以应对疾病的防控。
产能:
目前公司已经供应给武汉地区1000盒(5万人份)以上新型冠状病毒检测试剂盒,23日产能已进一步扩大,供以武汉为重点的全国各地区使用。按照每盒试剂盒可以供50人份使用来计算。
华大基因—国械注准20203400060
华大基因成立于1999年,并2017年7月于深交所主板上市,是国内领先的基因组学研发机构,也是我国基因行业的奠基者。目前已建成覆盖全球百余个国家和全国所有省市自治区的营销服务网络。
2020年1月初,华大基因即开始紧急研制相关试剂盒,由于该病毒与蝙蝠类SARS病毒的同源性较高,需要针对2019-nCoV,设计特异检测试剂盒,确保准确鉴定,避免形成交叉误判。
华大基因用72小时完成初步研发,并在通过严格的试剂盒工艺和质量控制等环节确保稳定性和准确性后,于1月14日官方宣布完成2019新型冠状病毒核酸检测试剂盒(RT-PCR荧光探针法)成品的全部研制工作。
2020年1月26日,国家药品监督管理局应急审批通过华大集团(下称“华大”)qixia的华大基因和华大智造2家公司的2个产品——新型冠状病毒检测试剂盒和DNBSEQ-T7测序系统,双双正式通过了国家药监局应急审批程序,成为首批正式获准上市的抗击疫情的检测产品。
产能:
华大集团内部人士表示:首批10万人份试剂盒将驰援疫情检测一线,另紧急追加生产20万人份试剂盒,还新储备了30万人份的试剂盒原料。目前,试剂盒日均产能已达到5万人份,并将根据疫情发展需要快速提升。
另外,1月22日,国家卫健委办公厅近日向各地卫健委下发《关于印发新型冠状病毒感染的肺炎诊疗方案(试行第二版)和全国各省(区、市)首例新型冠状病毒感染的肺炎病例确认程序的通知》(以下分别简称《诊疗方案》和《确认程序》)。特别提出将 华大基因有限公司列为制定唯一检测新型冠状病毒第三方检测机构。
这意味着,除国家公立医疗机构外,华大基因服务功能上升到国家医疗紧急战略层面,再次给行业人加深华大基因在国内基因测序领域的龙头地位,推动华大基因试剂产量、消耗体量大幅增加。
华大智造—国械注准20203400061
据华大官网通告,qixia华大智造基因测序系统正式通过国家药监局应急审批程序。
技术原理:联合探针锚定聚合测序技术
产品型号:基因测序仪DNBSEQ-T7,全自动样本加载仪MGIDL-T7
试剂使用场景:疾控中心为主、医院为辅
众所周知,新型冠状病毒疫情在初期时段,病毒样本都是需要移交给当地疾控中心、省级疾控中心确认诊断的。但到了疫情爆发阶段,随着疑似人数大幅增加、武汉市开启封城行动,样本运输时间受限等情况发生后,武汉市开放了部分医疗机构检测权限。只为全力“提速”,与病毒“赛跑”。
1月18日,根据国家卫健委发布的《关于印发新型冠状病毒感染的肺炎诊疗方案(试行第三版)》和《全国各省(区、市)首例新型冠状病毒感染的肺炎病例确认程序》。
明确表示:对于武汉之外的其他省市,审核不仅要经过省一级,还要上报国家,并由专家小组评估,三轮都确认,才能确诊。
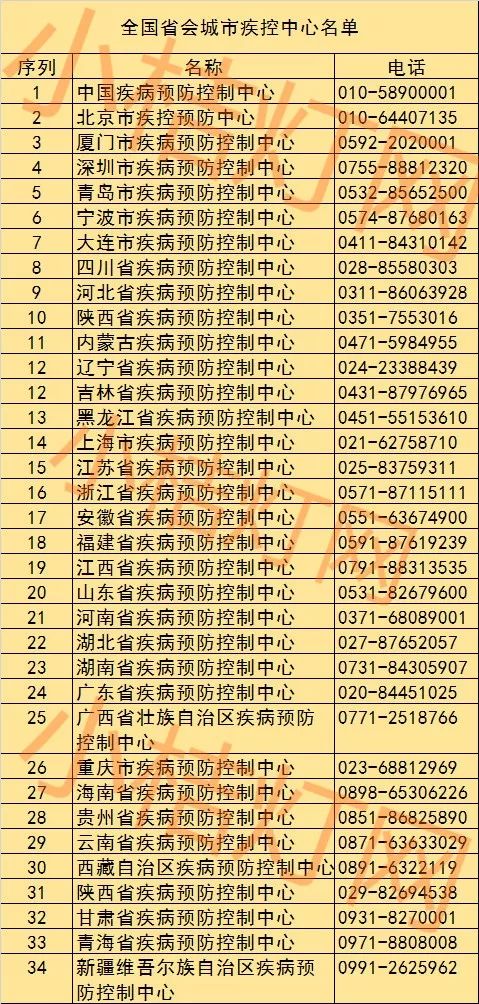
鉴于此,小桔灯网整理了全国34个省会城市疾控中心名单及联系方式,希望能够及时帮助到各位读者(附件一)。
另外:文末还附106家已研发出新型冠状病毒试剂企业名单(附件二)
(如有遗漏或者错误,请在留言区补充修订,谢谢。)
附件一:全国34个省会城市疾控中心名单:
附件二:106家已研发出新型冠状病毒试剂IVD企业名单 :
(注:按国内法规规定,需经过NMPA审批获证后的产品才能进入临床使用)














 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


