背景:降钙素原(PCT)指导抗生素管理(ABS),已经被证明可以减少抗生素使用(ABxs),具有较低的副作用并能改善临床结果。这次专家研讨的目的是为了在不同的临床环境中更容易地将PCT算法应用到临床程序中。
方法:临床证据与实践经验对PCT指导抗生素管理进行了分析和讨论。重点研究PCT在临床中的最佳应用以及加强对PCT协议的遵守。专家组使用Delphi程序,根据患者的临床严重程度和细菌感染的可能性,就不同的PCT算法达成共识。
结果:研究小组一致认为,有强有力的证据表明,PCT指导抗生素管理支持对任何来源的急性呼吸道感染和脓毒症患者开始接受抗生素治疗的起始治疗时间和持续时间的个性化决策,从而减少总体抗生素使用和相关的副作用,并改善临床结果。为了简化实际应用,专家组通过将疾病的严重程度和细菌感染的概率结合起来,并将固定的临界值减少到只有一个用于轻度到中度和一个用于严重疾病(分别为0.25μg/ L和0.5μg/L),从而改进了既定的PCT算法。此外,还包括对PCT结果的解释指导,以启动、中止或中止抗生素治疗。
结论:将临床患者评估与明确的抗生素管理算法中的PCT水平相结合,结合对所有抗生素管理利益相关方的持续教育和定期反馈,有可能改善疑似细菌感染患者的诊断和治疗管理,从而提高抗生素管理有效性。
关键词:抗生素管理;细菌感染;生物标志物;降钙素原;呼吸道感染;脓毒症。
多药耐药病原体的日益增多被认为是对全球健康的最紧迫威胁之一,并与抗生素的过度使用直接相关[1]。出现急性呼吸道疾病症状和全身炎症反应综合征(sirs)或疑似败血症的患者通常会默认使用抗生素,尽管40%以上的呼吸道感染是由病毒引起的[2,3]。例如,在最近的一项大型疾病控制中心(cdc)的研究中,86%的肺炎患者感染了病毒或没有被确认的病原体[3]。尽管快速分子病毒诊断技术的普及[4],但在“以防万一”的基础上,急性呼吸道疾病患者经常过量使用抗生素,这主要是由于医生担心细菌感染同时发生,因此保留抗生素以保证安全性。此外,医生经常长期使用抗生素治疗,因为缺乏最终证明疾病消退的临床参数。尽管患者可能表现出不同的治疗反应,但使用目前国际和当地指南所倡导的固定抗生素治疗方案可能会进一步延长治疗时间。
因此,提供有关细菌感染概率和疾病消退的信息的诊断标志物具有改善患者临床评估,帮助临床医生改进抗生素决策并可能改善临床结果的巨大潜力。在这种情况下,自身反应标记物降钙素原(PCT)的使用最近作为临床判断的辅助而备受关注。PCT水平有助于区分细菌和病毒性疾病,并且已被证明可以安全地降低抗生素处方的使用率并尽早停止治疗[5-7]。PCT在遇到细菌病原体的上皮细胞中表达为上升,从而在患者最初评估[8]时提供有关细菌感染风险的信息。相反,病毒感染[9]患者PCT表达为下降。一旦细菌感染得到控制,PCT也会降低,从而提供有关疾病消退的信息。将PCT纳入总体评估可以补充传统的临床参数和来自其他诊断和微生物测试的信息,并为怀疑细菌感染的患者提供治疗决策[10]。
使用PCT等生物标志物可能有助于个性化治疗决策。这种策略可减少抗生素接触,并可通过降低抗生素相关副作用和降低治疗失败风险来降低死亡率,如最近的试验所示[6,7]。此外,一些报告发现抗生素管理(ABS)方案对脓毒症患者的预后有积极作用,目前的脓毒症指南建议实施减少抗生素接触的策略[11-13]。对PCT动力学的了解也提供了预后信息,这些信息可能影响到获得进一步样本进行诊断测试或寻求其他治疗策略的决定以及病人出院的时间[14]。根据目前的证据,美国食品和药物管理局(FDA)最近批准使用PCT检测来指导美国急性呼吸道疾病和败血症的抗生素使用。
更常见的PCT常规使用的一个障碍是临床算法缺乏明确性,因为之前的试验都根据临床情况使用了不同的PCT协议(初级保健机构,急诊科[ED]和重症监护室) [ICU])和感染类型,例如社区获得性肺炎(CAP),支气管炎,慢性阻塞性肺病(COPD)或哮喘急性发作,脓毒症和术后脓毒症[8]。在跟踪PCT测量的时间和具体治疗建议方面,不同算法的建议有所不同。建议停止使用抗生素所使用的几个PCT临界点进一步增加了PCT算法的复杂性(急诊科和普通病房患者停用抗生素的临界值≤0.25/≤0.1μg/ L; ICU患者≤0.5/≤0.25μg/ L;脓毒症患者峰值水平降低≥80%)。此外,缺乏关于如何将PCT检测结果最佳地整合到患者的临床管理和抗生素治疗决策中的指导。因此,提出了一种适用于疑似细菌感染患者的一致算法,该算法考虑了这些因素,可以提高PCT在常规临床环境中的有效性和安全性。
因此,国际专家共识会议的目标是缩小这一差距,讨论如何在临床日常工作中最佳使用PCT,包括将PCT纳入临床协议和工作流程的先决条件,并就这些方面达成共识。
2018年9月下旬,在柏林举行的为期一天的研讨会上,各方达成了共识。这一共识是由来自12个国家的19位临床应用PCT专家组成的多学科团队形成的,反映医院抗生素管理计划中不同的功能性利益相关者,如重症监护医学(医学和外科重症监护),急救医学,呼吸医学,临床微生物学和传染病,药学,患者安全和实验室医学(见表1)。
表1:参与专家名单。
姓名 隶属 专业领域
专家组审查了PCT指导的抗生素管理介入试验的现有证据,并讨论了所使用的不同方法和算法,包括那些不会导至抗生素接触减少的方法和算法。专家们还讨论了不同患者群体的临床证据,如初级诊疗[15]、急诊科[16]、ICU[7、17]或老年病学,并从自己的日常临床实践经验中交流了实际经验。此外,还交流和讨论了这一过程的经验以及临床实施的影响。在讨论的基础上,提出了三种针对轻度、中度和重度疾病患者的PCT算法的改良。
有争议的问题被公开讨论,辩论,并在几个反馈回合中进一步编辑算法,通过纳入调整,直到找到共识。所有参加会议的代表随后对同一天的每个算法投票:1)同意,2)不同意或3)弃权。对于投票,使用了改进的Delphi程序[18]。
专家们对算法1、2、3进行了表决,在对所有三种最终算法进行表决时一致同意(图1-3)。
PCT算法用于呼吸道感染抗生素管理的临床试验
PCT指导抗生素管理的概念首先在急诊科患者中进行了下呼吸道感染检测[19]。考虑到PCT水平在病毒感染中值较低(未检测到)和细菌感染中值升高,如果PCT水平分别<0.1μg/ L或<0.25μg/ L,研究算法建议非常强烈或强烈反对使用抗生素。该算法还包括一些推定标准,因此尽管PCT水平较低,仍然可以凭经验应对高危患者。因此,对于PCT值更高的患者开始抗生素治疗也给出了两级建议,超过0.25μg/ L(建议使用抗生素)和PCT高于0.5μg/ L(强烈建议使用抗生素)。该研究表明抗生素处方率显着降低,特别是支气管炎和COPD恶化患者。
后来的研究不仅探讨了PCT对开始抗生素治疗的经验,还使用PCT来监测对治疗的反应,并决定在个人基础上停用抗生素治疗[19,20]。将PCT降至0.25μg/ L以下或从峰降低至少> 80%-90%用作停止规则阈值。这种方法通过缩短治疗持续时间进一步降低了抗生素接触,特别是在社区获得性肺炎患者中。随后,一项大规模的、随机的、非劣效性试验发现,这种方法可以非常有效地减少抗生素接触3天以上,不会增加不良后果的风险[16,21]。
今天,在不同的国家和不同的临床环境(即从初级诊疗到急诊科和医疗病房,到重症监护室)进行了几次类似的试验。最近的目标分析包括来自12个不同国家的26个随机对照试验的6708名不同类型和严重程度的呼吸道感染患者的个人数据,与汇总数据目标分析相比,调查了PCT引导下的抗生素决策在呼吸道感染情况下的影响[22,23]。患者级别的数据目标分析允许标准化结果定义和按感染类型和临床环境分组分析。该研究表明,PCT在呼吸道感染中的应用减少了抗生素接触(抗生素的开始率从86%降至72%,总接触量从8.1天降至5.7天),抗生素的副作用(从22.1%降至16.3) %)并且死亡率显着降低了14%(从10%降至8.6%)。结果与不同的临床环境(即初级诊疗,急诊科或重症监护)和感染类型(肺炎,支气管炎,慢阻肺恶化)一致。
对试验中使用的PCT cut-off值的二次分析表明,用于指导抗生素的主要cut-off值适应了患者的严重程度。因此,对于在初级诊疗或急诊科中治疗的轻度或中度疾病患者,使用的PCTcut-off值为0.25μg/ L,而对于患有严重疾病的患者(例如需要ICU入院的患者),主要使用的cut-off值为0.5μg/ L [24]。同样,对于抗生素停药,PCT降低至0.25μg/ L或0.5μg/ L以下分别用于轻度/中度或重度疾病,或当PCT从峰值下降≥80%时[8]。
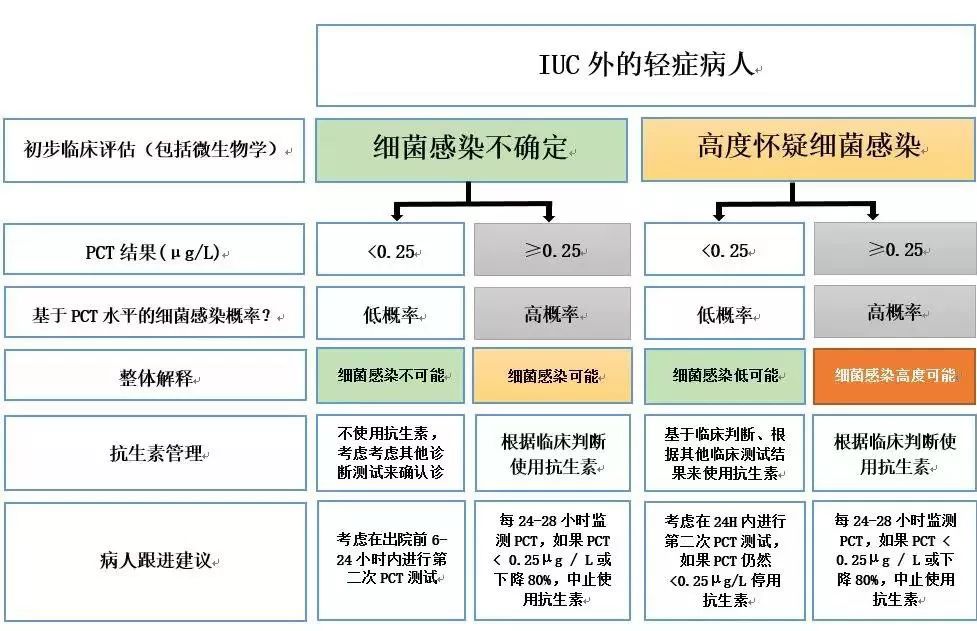
图1:ICU以外的轻症患者的PCT使用情况
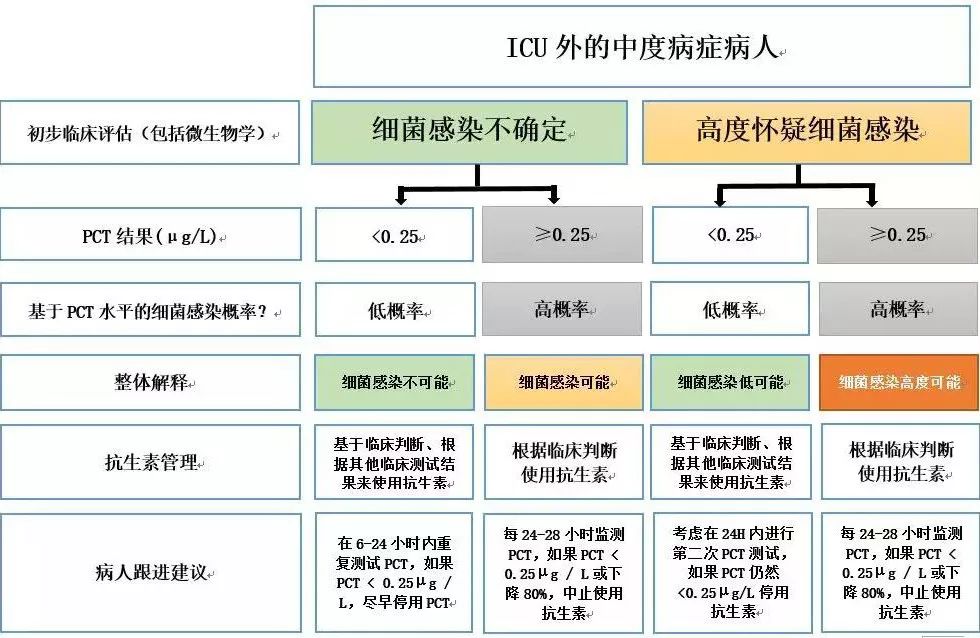
图2:ICU以外的中度病患者的PCT使用情况
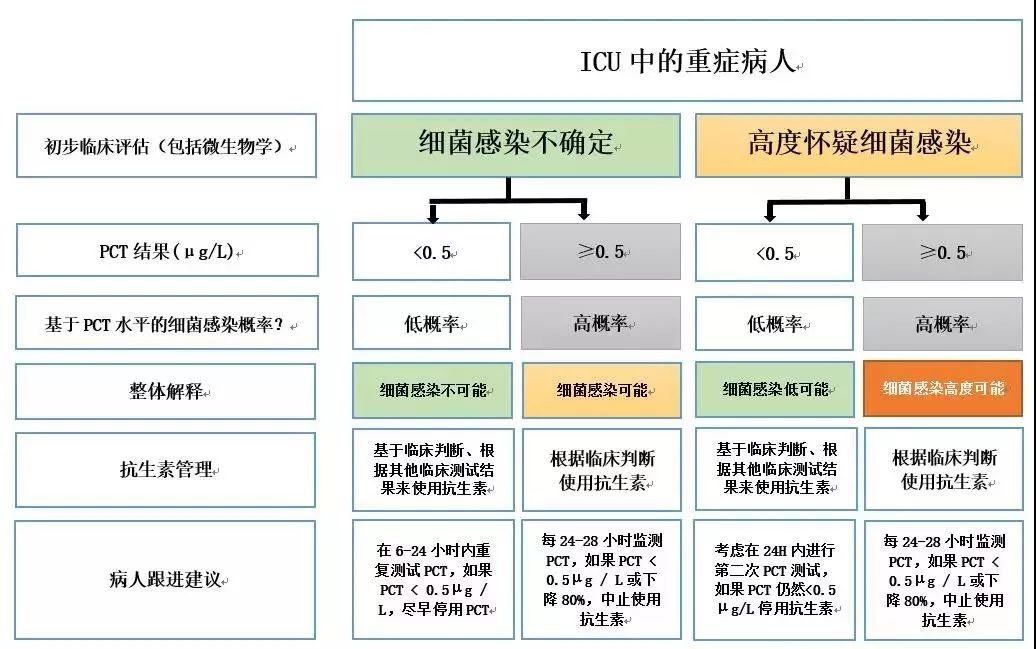
图3:ICU中的重症患者的PCT使用情况
对免疫抑制(包括hiv)、心衰、胰腺炎、外伤、妊娠、大量输血、疟疾患者应谨慎;PCT的指导不应适用于慢性感染患者(如脓肿、骨髓炎、心内膜炎)
脓毒症中PCT指导的抗生素管理的试验和算法
上述使用PCT进行个体化抗生素治疗的概念在ICU脓毒症患者中也很有吸引力。然而,由于抗生素疗程过短可能导至感染复发和更高的死亡率,人们最初担心这种方法对病情最严重的患者的安全性。第一项概念验证研究观察了ICU中脓毒症[14]患者,发现抗生素接触减少,但对结果没有明显的负面影响。试验使用了更高的PCT的cut-off值用于脓毒症患者(0.5 1μg / L),并使用PCT动力学(从峰值水平下降> 90%)来建议停止使用抗生素。这一概念后来在多中心,非劣效性等比例试验中得到验证[17],其中PCT用于脓毒症患者时是有效和安全的。由于ICU脓毒症患者具有先天的高风险且治疗时间至关重要,因此PCT主要用于早期停止治疗,而非指导经验治疗[25]。这个概念后来也在降钙素原停止抗生素中(SAPS)研究的指导进行了测试,其中临床怀疑脓毒症的所有患者都开始使用抗生素,但是当PCT峰值水平下降至少80%时和/或当PCT降至0.5μg/ L以下时,建议停用抗生素。与护理标准相比,PCT的使用减少了抗生素接触(抗生素持续使用时间从7天减少到5天),改善了生存率(1年生存率提高6.1%)[7]。
最近对11项PCT指导下的脓毒症[26]危重症患者进行的患者水平目标分析也发现,2252例PCT指导下的患者死亡率明显低于对照组的2230例(21.1% vs. 23.7%)。根据感染类型(呼吸道,泌尿道,腹部,皮肤或中枢神经系统),脓毒症-3的定义或脓毒症的严重程度(由顺序器官衰竭评估[SOFA]评分定义)分组的亚组分析中,这一发现是一致的。存在感染性休克或肾功能衰竭,或需要血管加压或通气支持)。该研究还显示,在脓毒症患者中,PCT使用导至早期停用抗生素,治疗持续时间从10.4天减少到9.3天,对于脓毒症较轻的患者和呼吸道感染患者的效果更强。另一项元分析还显示,生存获益仅与停止使用抗生素的PCT算法相关,而对于ICU患者,PCT算法用于抗生素启动或混合方法并未降低死亡率[27]。最后,一项关注具有阳性培养的菌血症患者的目标分析也发现PCT使用对抗生素使用的显着影响,尽管抗生素持续时间较短,但没有证据表明临床结果不良[28]。
从“负面”的研究中学习
除了已有研究表明PCT指导抗生素管理的有效性和安全性外,也有一些研究结果为负面的。
首先,PASS试验是一项介入性研究,其目的是通过早期的抗生素干预和PCT升高时的随时升级来提高生存率。尽管在PCT指导干预组中诊断和治疗措施有所提高,但没有任何疗效。缺乏效果的原因可能是早期治疗的益处与由于抗生素治疗升级而产生的副作用相抵消[29,30]。
其次,最近发表的多中心ProACT试验研究了PCT对美国医院下呼吸道感染(LRTI)的影响,尽管在欧洲的研究[24]中已经成功地使用了类似的算法,但[31]未能证明PCT指导有任何好处。几个因素可能导至了这个结果。包括疾病严重程度极低且细菌感染可能性低的患者(PCT中位数极低,主要是轻度CAP,哮喘和支气管炎患者数量较多),无论是入院还是出院的患者,对算法和研究协议的依从性都很差,内科医生缺乏对PCT的经验,以及对照组和PCT组的总抗生素使用时间非常短[24]。研究人员使用PCT的经验不足和干预组的容错率较低(2.5年/中心的26-111名患者)这使临床医生几乎没有机会获得PCT概念的实际经验,并对该方法产生信任。
第三,最近发表的HiTEMP研究调查了PCT在指导急诊发热患者抗生素治疗方面的价值,包括抗生素处方率、临床结果和[32]成本。研究人员没有发现PCT有任何额外的好处,这表明尽管PCT引导的治疗在安全性方面并不差,但它并没有减少抗生素的处方。本研究也得到了一些重要的经验教训,这可能有助于更好地理解PCT在临床实践中的应用,并应在设计未来的试验时加以考虑。该试验包括未选择的发热患者,包括诊断不确定的患者(如皮肤和软组织、腹腔内和尿道感染患者)。在这类患者中,PCT几乎没有增加临床判断价值的潜力,因为已经决定开始使用抗生素。研究者在急诊入院时仅使用单次PCT测量,PCT cut-off高(>0.5μg/ L)。由于细菌感染的预测概率高的患者的默认通常是开抗生素处方,因此必须具有较高的阴性预测值,所以较低的PCT水平<0.25μg/ L或<0.1μg/ L可能更为可取, 允许安全的保留抗生素。大多数以前的试验依赖于重复的PCT测量来进行早期停药,本试验仅使用单一的[24]测量。尽管PCT水平较低,但对研究PCT方案的依从性较低,有一半患者接受了抗生素治疗,这再次说明在实施PCT指导的护理时需要对提供者进行教育和反馈。
第四,BPCTrea研究调查了PCT算法,以指导入住ICU的COPD患者进行抗生素治疗以获得呼吸机支持[34]。虽然PCT和标准治疗组的28天死亡率相似,但PCT组的3个月死亡率较高。在没有立即根据方案进行抗生素治疗的患者中,死亡率的增加最为显着。对于立即接受抗生素治疗的患者,PCT组的结果不逊于标准治疗组。这些数据支持以下建议:这些数据支持对高危疑似细菌感染患者应立即开始抗生素治疗以提高PCT使用安全性的建议。
临床整合到抗生素管理计划的真实世界数据
实践证明,抗生素管理项目的成功实施需要全院的整体方案,教育所有利益相关者是关键因素。理想的教育过程包括定期审核,基于明确的结果参数对成功进行评估,并向所有相关方反馈,以增加信任、信心和最终的坚持,从而达到减少抗生素使用从而减少抗生素耐药性的预期效果。
这也同样适用于整合PCT以指导在疑似细菌感染患者中合理使用抗生素。在一些介入研究如proACT[31]中观察到的低依从率反映了缺乏PCT的经验及其在临床背景下的解释,以及缺乏对该方法的有效性和安全性的信任。相反,基于教育的成功的临床整合PCT指导抗生素导至减少使用抗生素和降低耐药率,并与改善临床结果相关,如较低的再入院率,较少的艰难梭菌感染和较短的住院时间,对生存无任何负面影响。因此,教育可能会增加医生的信心,当与患者更好地沟通与不恰当抗生素治疗相关的风险时,可以提高算法的依从性,减少抗生素的过度使用[10,36]。
临床试验和实施研究的结果都支持这样的观点,即PCT的cut-off和算法需要根据患者的严重程度和临床风险进行调整,以确保有效和安全的使用,并且需要进行教育、审计和持续反馈,以培养对PCT算法的信任,并提高对PCT算法的依从性。
推导PCT使用的一致性算法
根据对试验的分析,专家组一致认为,为了获得最佳的使用效果,应将PCT水平纳入临床评估的范围,以确定疾病的严重程度和细菌感染的可能性。因此,我们根据疾病的严重程度(即轻度,中度和重度疾病)得出三种不同的算法,并根据细菌感染的可能性(不确定性与高度怀疑的细菌感染)对患者进行分层(图1-3)。然后应将PCT添加到非ICU患者PCTcut-off值<0.25μg/ L和ICU患者<0.5μg/ L的患者的评估中,表明细菌感染的可能性较低。在患有轻度疾病且细菌感染可能性低的患者中,低PCT水平应建议医生不要使用抗生素,对于中度或高度严重的患者,经验性治疗仍需在6-24小时后重新测试PCT以评估抗生素治疗的必要性。此外,对于开始经验性抗生素治疗的患者,建议对PCT水平进行连续测试,以监测对抗生素治疗和感染控制的反应。PCT从峰值下降> 80%和/或低于cut-off值被视为解决疾病的有力指标,并且当患者临床稳定时,建议尽早停用抗生素。
图1显示了针对轻度疾病患者(如在初级护理中常见的患者或患有支气管炎的急诊患者)提出的算法。第一步是根据临床评估、影像学评估(如有)和微生物检查评估细菌感染的预检测概率。对于轻度疾病和关于细菌感染的诊断不确定性的患者,低PCT水平<0.25μg/ L有效地排除细菌感染,并且抗生素治疗无效。然而,可能需要额外的诊断测试来确定最终诊断(非传染性)。如果担心早期感染导至初始值为阴性,可以考虑在患者出院前6-24小时内进行第二次PCT检测。如果PCT > 0.25μg / L升高,细菌感染的存在变得更有可能,如果临床环境是适合的,应该开始抗生素治疗。PCT水平应每24-48小时重新测量一次,当水平降至0.25μg/ L以下或相对于峰值降低至少80%时停止使用抗生素。
在基于临床,放射学和微生物学评估的轻度疾病和高度怀疑细菌感染的患者中,PCT <0.25μg/ L仍然反对判定为细菌感染,但可以根据临床判断开始使用抗生素。同样,在24小时后进行第二次PCT测试和其他微生物测试结果时,应重新评估抗生素使用的是否适用。如果PCT>0.25μg/ L,则很可能发生细菌感染,应立即开始经验性的使用抗生素。应每24-48小时重新测试PCT水平,以评估对治疗的反应和对感染性病灶的控制。如果患者临床稳定,且PCT相对于峰值下降> 80%或下降至<0.25μg/ L,则可以停用抗生素。
图2显示了通过临床评分评估的中度疾病严重程度的算法。在这种情况下,PCT的使用与轻度疾病相似,但对于诊断不确定的患者,尽管PCT水平低,但仍可建议经验性的抗生素治疗,以提高医生治疗的安全性和依从性。
图3显示了ICU中高严重度患者的建议算法,建议所有患者(包括PCT低的患者)进行抗生素治疗。然而,对于PCT <0.5μg/ L的患者,应开始进一步的诊断测试,以寻找临床症状或真菌感染的非细菌原因。建议每24-48小时重复测试一次,当PCT水平降至<0.5μg/ L或峰值至少80%时,决定停用抗生素。
对于所有提出的算法,建议对免疫抑制(包括艾滋病毒)、自身免疫性疾病、囊性纤维化(CF)、胰腺炎、创伤、妊娠、大量输血和疟疾患者谨慎使用。此外,该算法应用于急性感染,但不应用于慢性感染(例如脓肿,骨髓炎,心内膜炎)的患者。如果患者接受抗生素预处理[37],PCT水平也可能较低,导至可能低估感染性并发症。对于PCT的测量,应该确保只有在相关cut-off范围内具有足够精度的高灵敏度PCT测定才能获得最佳的安全性。今天的大多数试验都使用了高灵敏度的KRYPTOR免疫分析法(BRAHMS,Hennigsdorf,德国),其功能灵敏度为0.06μg/ L [38,39]。因此,由功能灵敏度表示的分析灵敏度应在此范围内,以确保在低PCT水平下测量的准确性。此外,测定的验证应确保准确性(偏差和不精确)应该是适当的[34,35]。
PCT作为一种具有诊断和预后影响的标志物,已显示出有前景的结果,可针对单个患者定制抗生素治疗,从而减少抗生素接触,改善急性呼吸道感染和脓毒症患者的临床结果[6,23,40,41]。各种临床算法已在介入试验中得到验证,证明PCT指导抗生素管理的有效性和安全性。在实验和现实生活中,对PCT算法的了解常常是一个具有挑战性的问题,这是由于缺乏经验,因此对解释和后续措施缺乏安全感。此外,除了下呼吸道感染或脓毒症外,其他感染的证据仍然很少,而且很少有试验包括免疫抑制患者,因此限制了这些患者的研究结果的普遍性[42]。这些方面在算法的改进中都得到了考虑,目前的算法基于对疾病严重程度和细菌感染概率的临床评估,仅使用一个严重程度特异性的PCT cut-off值来重新计算感染概率。
临床算法的共识通常由各自的科学学会专家组制定,用于特定适应症。我们的方法的一个优势是,这个国际专家组由代表医院抗生素管理项目中不同功能的专家组成,他们都具有深厚的PCT科学、临床和实践经验(表1)。在深入分析和讨论现有临床证据和使用的不同PCT算法的基础上,就改进算法达成了共识,包括对结果为“阴性”的研究进行批判性评价,以及从不同专家的角度对抗生素管理的实践经验。在此基础上,确定并讨论了在临床常规中实际应用PCT和遵守现有协议所面临的挑战,以调整抗生素管理的算法,为PCT的过程、结果解释和后续措施提供明确的指导。改进后的算法提供了一种更统一的方法,为轻度至中度或重度疾病患者提供指导,独立于适应症或部门,这应该有助于跨部门采用。我们的建议是,PCT主要用于不确定细菌感染的低风险患者开始使用抗生素,其他患者监测PCT,尽早停止抗生素治疗。在高危患者中,该算法侧重于在PCT较低且无细菌感染证据的情况下尽早停止治疗。对于轻度至中度重度和重度患者(分别为0.25μg/ L和0.5μg/ L)的一个cut-off值的规格有助于实施的简便性。尽管如此,我们的方法仍然存在一些局限性。虽然共识算法是基于临床证据和cut-off和算法主要已经证明在介入性试验中的有效性和安全性,但所提出的算法修改是基于该组的专家意见,但是实际实施的假设优势应该仍然是需要在临床实践中证明。
本文提出的改进算法应能使临床更容易地跨部门采用,因为它还包括对后续措施的建议。PCT的经验和正确使用的教育仍然是利用PCT指导治疗[35]的重要先决条件。对真实世界数据(如来自登记处的数据)有更广泛的了解将有助于评估不同国家的临床和健康经济影响。临床研究应同时考虑较少了解的适应症或患者群体,以及初级护理和/或护理院内的患者,这些患者需要开大量抗生素。
综上所述,将PCT整合到抗生素管理算法中,有改善呼吸系统疾病和脓毒症患者的诊断和治疗管理的潜力,并有望缓解全球细菌耐药性危机,从标准化护理转向更加个性化的治疗决策。
参考文献
Jee Y, Carlson J, Rafai E, Musonda K, Huong TT, Daza P, et al. Antimicrobial resistance: a threat to global health. Lancet Infect Dis 2018;18:939–40.
Musher DM, Thorner AR. Community-acquired pneumonia. N Engl J Med 2014;371:1619–28.
Jain S, Self WH, Wunderink RG, Fakhran S, Balk R, Bramley AM, et al. Community-acquired pneumonia requiring hospitalization among U.S. adults. N Engl J Med 2015;373:415–27.
Mitsuma SF, Mansour MK, Dekker JP, Kim J, Rahman MZ, TweedKent A, et al. Promising new assays and technologies for the diagnosis and management of infectious diseases. Clin Infect Dis 2013;56:996–1002.
Schuetz P, Raad I, Amin DN. Using procalcitonin-guided algorithms to improve antimicrobial therapy in ICU patients with respiratory infections and sepsis. Curr Opin Crit Care 2013;19:453–60.
Schuetz P, Wirz Y, Sager R, Christ-Crain M, Stolz D, Tamm M, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis. Lancet Infect Dis 2018;18:95–107.
de Jong E, van Oers JA, Beishuizen A, Vos P, Vermeijden WJ, Haas LE, et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis 2016;16:819–27.
Schuetz P, Bolliger R, Merker M, Christ-Crain M, Stolz D, Tamm M, et al. Procalcitonin-guided antibiotic therapy algorithms for different types of acute respiratory infections based on previous trials. Expert Rev Anti Infect Ther 2018;16:555–64.
Linscheid P, Seboek D, Nylen ES, Langer I, Schlatter M, Becker KL, et al. In vitro and in vivo calcitonin I gene expression in parenchymal cells: a novel product of human adipose tissue. Endocrinology 2003;144:5578–84.
Sager R, Kutz A, Mueller B, Schuetz P. Procalcitonin-guided diagnosis and antibiotic stewardship revisited. BMC Med 2017;15:15.
Garnacho-Montero J, Gutierrez-Pizarraya A, Escoresca-Ortega A, Corcia-Palomo Y, Fernandez-Delgado E, Herrera-Melero I, et al. De-escalation of empirical therapy is associated with lower mortality in patients with severe sepsis and septic shock. Intensive Care Med 2014;40:32–40.
Schuetz P, Mueller B. Biomarker-guided de-escalation of empirical therapy is associated with lower risk for adverse outcomes. Intensive Care Med 2014;40:141.
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016. Intensive Care Med 2017;43:304–77.
Nobre V, Harbarth S, Graf JD, Rohner P, Pugin J. Use of procalcitonin to shorten antibiotic treatment duration in septic patients: a randomized trial. Am J Respir Crit Care Med 2008;177:498–505.
Briel M, Schuetz P, Mueller B, Young J, Schild U, Nusbaumer C, et al. Procalcitonin-guided antibiotic use vs a standard approach for acute respiratory tract infections in primary care. Arch Intern Med 2008;168:2000–7; discussion 7–8.
Schuetz P, Christ-Crain M, Thomann R, Falconnier C, Wolbers M, Widmer I, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial. J Am Med Assoc 2009;302:1059–66.
Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C, et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 2010;375:463–74.
Memtsoudis SG, Hargett M, Russell LA, Parvizi J, Cats-Baril WL, Stundner O, et al. Consensus statement from the consensus conference on bilateral total knee arthroplasty group. Clin Orthop Relat Res 2013;471:2649–57.
Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet 2004;363:600–7.
Stolz D, Christ-Crain M, Bingisser R, Leuppi J, Miedinger D, Muller C, et al. Antibiotic treatment of exacerbations of COPD: a randomized, controlled trial comparing procalcitonin-guidance with standard therapy. Chest 2007;131:9–19.
Schuetz P, Christ-Crain M, Albrich W, Zimmerli W, Mueller B, Pro HS. Guidance of antibiotic therapy with procalcitonin in lower respiratory tract infections: insights into the ProHOSP study. Virulence 2010;1:88–92.
Schuetz P, Wirz Y, Mueller B. Reassessment of a meta-analysis of procalcitonin-guided antibiotic therapy for lower respiratory tract infections – authors’ reply. Lancet Infect Dis 2018;18:141.
Schuetz P, Wirz Y, Sager R, Christ-Crain M, Stolz D, Tamm M, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev 2017;10:CD007498.
Schuetz P, Chiappa V, Briel M, Greenwald JL. Procalcitonin algorithms for antibiotic therapy decisions: a systematic review of randomized controlled trials and recommendations for clinical algorithms. Arch Intern Med 2011;171:1322–31.
Ferrer R, Martin-Loeches I, Phillips G, Osborn TM, Townsend S, Dellinger RP, et al. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: results from a guideline-based performance improvement program. Crit Care Med 2014;42:1749–55.
Wirz Y, Meier MA, Bouadma L, Luyt CE, Wolff M, Chastre J, et al. Effect of procalcitonin-guided antibiotic treatment on clinical outcomes in intensive care unit patients with infection and sepsis patients: a patient-level meta-analysis of randomized trials. Crit Care 2018;22:191.
Lam SW, Bauer SR, Fowler R, Duggal A. Systematic review and meta-analysis of procalcitonin-guidance versus usual care for antimicrobial management in critically Ill patients: focus on subgroups based on antibiotic initiation, cessation, or mixed strategies. Crit Care Med 2018;46:684–90.
Meier MA, Branche A, Neeser OL, Wirz Y, Haubitz S, Bouadma L, et al. Procalcitonin-guided antibiotic treatment in patients with positive blood cultures: a patient-level meta-analysis of randomized trials. Clin Infect Dis 2018.
Jensen JU, Hein L, Lundgren B, Bestle MH, Mohr TT, Andersen MH, et al. Procalcitonin-guided interventions against infections to increase early appropriate antibiotics and improve survival in the intensive care unit: a randomized trial. Crit Care Med 2011;39:2048–58.
Jensen JU, Lundgren B, Hein L, Mohr T, Petersen PL, Andersen LH, et al. The procalcitonin and survival study (PASS) – a randomised multi-center investigator-initiated trial to investigate whether daily measurements biomarker procalcitonin and pro-active diagnostic and therapeutic responses to abnormal procalcitonin levels, can improve survival in intensive care unit patients. Calculated sample size (target population): 1000 patients. BMC Infect Dis 2008;8:91.
Huang DT, Yealy DM, Filbin MR, Brown AM, Chang CH, Doi Y, et al. Procalcitonin-guided use of antibiotics for lower respiratory tract infection. N Engl J Med 2018;379:236–49.
van der Does Y, Limper M, Jie KE, Schuit SCE, Jansen H, Pernot N, et al. Procalcitonin-guided antibiotic therapy in patients with fever in a general emergency department population: a multicentre non-inferiority randomized clinical trial (HiTEMP study). Clin Microbiol Infect 2018;24:1282–9.
Schuetz P, Falsey AR. Procalcitonin in patients with fever: one approach does not fit all. Clin Microbiol Infect 2018;24:1229–30.
Daubin C, Valette X, Thiolliere F, Mira JP, Hazera P, Annane D, et al. Procalcitonin algorithm to guide initial antibiotic therapy in acute exacerbations of COPD admitted to the ICU: a randomized multicenter study. Intensive Care Med 2018;44:428–37.
Broyles MR. Impact of procalcitonin-guided antibiotic management on antibiotic exposure and outcomes: real-world evidence. Open Forum Infect Dis 2017;4:ofx213.
Schuetz P, Aujesky D, Muller C, Muller B. Biomarker-guided personalised emergency medicine for all – hope for another hype? Swiss Med Wkly 2015;145:w14079.
Tessmer A, Welte T, Martus P, Schnoor M, Marre R, Suttorp N. Impact of intravenous {beta}-lactam/macrolide versus {beta}lactam monotherapy on mortality in hospitalized patients with community-acquired pneumonia. J Antimicrob Chemother 2009;63:1025–33.
Schuetz P, Christ-Crain M, Wolbers M, Schild U, Thomann R, Falconnier C, et al. Procalcitonin guided antibiotic therapy and hospitalization in patients with lower respiratory tract infections: a prospective, multicenter, randomized controlled trial. BMC Health Serv Res 2007;7:102.
Schuetz P, Albrich W, Christ-Crain M, Chastre J, Mueller B. Procalcitonin for guidance of antibiotic therapy. Expert Rev Anti Infect Ther 2010;8:575–87.
Schuetz P, Balk R, Briel M, Kutz A, Christ-Crain M, Stolz D, et al. Economic evaluation of procalcitonin-guided antibiotic therapy in acute respiratory infections: a US health system perspective. Clin Chem Lab Med 2015;53:583–92.
Stojanovic I, Schneider JE, Wei L, Hong Z, Keane C, Schuetz P. Economic evaluation of procalcitonin-guided antibiotic therapy in acute respiratory infections: a Chinese hospital system perspective. Clin Chem Lab Med 2017;55:561–70.
Lima SS, Nobre V, de Castro Romanelli RM, Clemente WT, da Silva Bittencourt HN, Melo AC, et al. Procalcitonin-guided protocol is not useful to manage antibiotic therapy in febrile neutropenia: a randomized controlled trial. Ann Hematol 2016;95:1169–76.












 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


