2018年即将举行的外泌体与疾病研讨会在有关外泌体的基础研究方面主要对如下几个方面进行了报道:外泌体与肿瘤生长和转移、干细胞功能研究、介导的神经-血管调节、以及与肿瘤耐药和外泌体在病原体感染中的作用研究。在外泌体的临床研究方面,外泌体标志物(非编码RNA,蛋白)与疾病诊断、外泌体作为药物递送载体、外泌体的改造及修饰、外泌体在液体活检领域的应用以及外泌体与再生医学是该次会议关注的重点。此外研讨会还对对外泌体的分离和检测技术进行了详细的讨论。
本期文章研究性文章主要内容包括:KRAS突变、胰腺癌、外泌体RNA和ctDNA的液体活检,原癌基因细胞质酪氨酸激酶(SRC)、microRNA-21 、KRAS突变、肿瘤微环境等。
外泌体与肿瘤生长和转移:Nature:用外泌体抑制KRAS突变 治疗胰腺癌
Yang S, Che S P, Kurywchak P, et al. Detection of mutant KRAS and TP53 DNA in circulating exosomes from healthy individuals and patients with pancreatic cancer[J]. Cancer Biology & Therapy, 2017, 18(3):158-165.
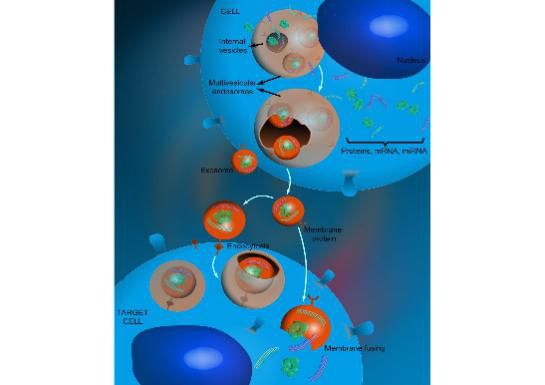
许多已知的致癌基因并不是一个好的药物靶点,这可能由很多原因导至,比如说没有理想的小分子结合部位,或者药物可能同时抑制与其相似的其它蛋白的功能而导至副作用。其中一个很好的例子就是胰腺癌中常见的KRAS突变基因。胰腺癌是一种非常凶险的癌症,死亡率极高,但是又没有有效的药物。研究显示超过90%的胰腺癌带有KRAS突变,KRAS突变不仅能引发癌症,还能加速肿瘤生长和转移。
令人遗憾的是,KRAS蛋白是一个“不可成药”的靶点,许多寻找靶向药物的尝试都失败了。近来RNA干扰(RNAi)技术的发展给癌症靶向治疗又带来的新希望。使用小分子RNA可以选择性地阻止致癌基因的表达,同时又不影响正常基因的功能,理论上是一种理想的靶向治疗方法。不过,由于RNA分子的高度不稳定性,如何将RNA送到肿瘤是一个新难题。研究者尝试了病毒、脂质体、纳米颗粒都多种手段,却遭遇了运送效率低,以及引起免疫反应导至载体被清除出系统等问题。
以前Yang S,在来自胰腺癌患者循环的外泌体中发现了双链基因组DNA,这使得能够检测与该疾病相关的流行突变。在这项研究中他们证明了循环exosomal DNA的潜在临床用途:用于鉴别胰腺相关病变(包括胰腺导管腺癌(PDAC),慢性胰腺炎(CP))患者中的KRASG12D和TP53R273H突变和导管内乳头状黏液性肿瘤(IPMN)和健康的人类受试者。在来自PDAC患者的48个血清样品中,外泌体DNA PCR分析在39.6%的病例中鉴定到KRASG12D突变,在4.2%的病例中鉴定到TP53R273H突变。在来自IPMN患者的外泌体DNA中也检测到KRASG12D和TP53R273H突变(7个中的2个与KRASG12D,其中一个也与TP53R273H突变共存)。在9例CP患者中有5例循环外泌体DNA能够检测到KRASG12D突变。在114例健康受试者来源的循环性外泌体DNA中,2.6%呈现KRASG12D突变,无TP53R273H突变。这项研究突出了循环exosomal DNA的价值快速,低成本鉴定癌症驱动突变。 IPMN患者和健康受试者中的突变鉴定表明,液体活检可能允许对癌症风险进行潜在评估,但应提醒注意的是不能检测到临床癌症。
外泌体与肿瘤耐药:外泌体通过结肠癌细胞中的PTEN / Akt途径促进西妥昔单抗抗性。
Zhang S, Zhang Y, Qu J, et al. Exosomes promote cetuximab resistance via the PTEN/Akt pathway in colon cancer cells.[J]. Braz J Med Biol Res. 2018, 51.

西妥昔单抗广泛用于KRAS的转移性结肠癌患者。但获得性耐药影响其临床疗效。外泌体是由各种细胞类型分泌的纳米囊泡。肿瘤细胞来源的外泌体参与许多生物过程,包括肿瘤侵袭,转移和耐药性。Zhang S发现西妥昔单抗耐药的RKO结肠癌细胞的外泌体在西妥昔单抗敏感的Caco-2细胞中诱导了西妥昔单抗的耐药性。同时,RKO和Caco-2细胞的外泌体显示出不同水平的磷酸酶和张力蛋白同系物(PTEN)和磷酸化Akt。此外,暴露于来自RKO细胞的外泌体下,在Caco-2细胞中发现PTEN降低和磷酸化的Akt水平升高。此外,Akt抑制剂阻止了Caco-2细胞中来自RKO细胞的外泌体诱导的药物抗性。这些发现表明西妥昔单抗抗性细胞的外泌体可以通过下调PTEN和增加磷酸化的Akt水平在西妥昔单抗敏感的细胞中诱导西妥昔单抗抗性。
外泌体与干细胞功能研究

王越教授现任第二军医大学组织胚胎学教研室主任,是转化医学中心外泌体转化研究平台负责人,主要从事干细胞与外泌体领域的基础与转化医学研究工作。近5年带领团队在干细胞的非编码RNA调控机制、外泌体临床转化研究方面取得了大量成果,发现了以非编码RNA miR-181、linc-RoR、snoRNA 7A为代表的一系列干细胞自我更新调控分子,并阐明了干细胞中的内源性microRNA海绵作用机制。
王越教授谈到,就目前很多的证据来看,干细胞外泌体具有其他细胞外泌体所不具有的某些作用,也有独特的分子表达谱。比如我们自己的一项研究,就发现干细胞外泌体可以促进皮肤瘢痕的愈合,而且其中有独特的一类microRNA存在。外泌体相比活细胞而言,成分比较确定,易于质量控制;而干细胞产品在运输和保存环节上更是有很多问题,外泌体就相对而言运输和保存简单的多。这是一些比较明显的差异,还有体内安全性、靶向性等等在理论上也存在差异,值得我们再去研究验证。
外泌体介导的神经-血管调节:内皮细胞衍生的外泌体保护SH-SY5Y神经细胞免于缺血/再灌注损伤
Xiao B, Chai Y, Lv S, et al. Endothelial cell-derived exosomes protect SH-SY5Y nerve cells against ischemia/reperfusion injury[J]. International Journal of Molecular Medicine, 2017, 40(4):1201. 
脑缺血是导至死亡和残疾的主要原因。以往的研究表明,缺血后处理(RIP)治疗脑缺血可减少缺血/再灌注(I / R)损伤。但是,其机制还不是很清楚。在本研究中,作者假设RIP对神经损伤的保护作用是由内皮细胞在股动脉中释放的外泌体介导的。为了测试这一点,南昌大学的Lv团队在大鼠中进行右大脑中动脉闭塞/再灌注。另外,测试了包括人脐静脉内皮细胞(HUVEC)和SH-SY5Y细胞的I / R损伤细胞模型。检查体内和体外模型的损伤。通过免疫组织化学,免疫印迹分析和流式细胞术评估外泌体(CD63,HSP70和TSG101)的标记。从动物血清和HUVEC培养基中提取外泌体,并通过电子显微镜鉴定。他们研究了内皮细胞衍生的外泌体在I / R损伤的SH-SY5Y细胞的增殖,凋亡,细胞周期,迁移和侵袭中的作用。另外还检测到凋亡相关分子caspase-3,Bax和Bcl-2。 RIP被确定为增加外泌体的数量和血浆中CD63,HSP70和TSG101的表达水平,而不是脑海马组织中的表达水平。 HUVECs中I / R后释放的外泌体的大小与经受RIP的大鼠中释放的外泌体的大小相似。
结果表明:内皮细胞来源的外泌体部分抑制了I / R诱导的细胞周期阻滞和凋亡,并抑制SH-SY5Y神经细胞的增殖,迁移和侵袭。内皮细胞衍生的外体直接保护神经细胞免受I / R损伤,并负责RIP在I / R中的保护作用。
外泌体在病原体感染中的作用:Cell:外泌体介导了果蝇的抗病毒适应性免疫
Tassetto M, Kunitomi M, Andino R. Circulating Immune Cells Mediate a Systemic RNAi-Based Adaptive Antiviral Response in Drosophila[J]. Cell, 2017, 169(2):314.
几十年来,果蝇一直是先天免疫研究的模式动物。在最新一期的Cell杂志上,加州大学旧金山分校Tassetto教授等人描述了抗病毒RNAi扩散的机制,通过反向转录的vDNA环和包含小RNA的外泌体全身传播,相当于哺乳动物适应性免疫。
多细胞生物体内有效的抗病毒保护依赖于细胞和全身免疫。系统免疫介导了抗病毒信号从感染部位扩散到远处的未感染组织。在节肢动物中,RNA干扰(RNAi)负责抗病毒防御。该研究显示果蝇具有由巨噬细胞样血细胞介导的复杂的基于全身RNAi的免疫。血细胞从感染的细胞中摄取dsRNA,通过内源转座子逆转录酶产生病毒衍生的互补DNA(vDNA)。这些vDNA模板从头合成二级病毒siRNA(vsRNA),分泌到外泌体样囊泡中。有趣的是,从感染果蝇的血淋巴中纯化的含有vsRNA的外泌体,在幼稚动物中赋予了针对病毒攻击的被动保护。因此,类似于脊椎动物,昆虫使用免疫细胞产生免疫记忆,其形式是稳定的vDNA,产生由含有vsRNA的外泌体介导的全身免疫。 | 


 /3
/3 