登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
全球人口老龄化和不断延长的寿命确保了对医疗器械的持续需求。根据Mordor Intelligence发布的《全球医疗器械技术市场的增长,趋势和展望(2014-2020)》,预计在2020年底全球医疗器械领域的市场总额将达到6420亿美元。2016年,日本已经成为这一领域内仅次于美国和欧洲的最大市场之一。 尽管日本官方在最近几年已经对医疗器械的监管程序做出了简化,但对于外国公司来说,想进入这个重要的市场仍然显得相当复杂。所以,能否更好的理解其监管流程和市场障碍成为了节约时间,缩减成本和规避风险的关键所在。 市场 根据日本厚生劳动省(MHLW)的医药工业产业年报显示,2014年日本医疗器械与材料的市场总额是325亿美元,其中59%来自于国内产品,41%来自进口。其中占比最大的治疗领域是手术器械与供应(26.3%),紧随其后的是诊断图像系统(14.6%)和人造内部器官与辅助装置(13.3%)。 如今的日本拥有全球最高的老年人口比例,且其人口持续快速老龄化。根据国际经合组织(OECD Insights)的文章《萎缩国家的案例:五张图表解析日本的人口和政策挑战》,日本80岁以上老龄人口比例从1950年的0.4%增长到了2010年的7.3%(国际经合组织的平均水平为4.1%)。以目前的趋势,日本政府预测在2010年到2050年之间的人口数将下降22-23%,而65岁以上的老龄人口比例将上升至40%。老龄化现象激发了对一系列商品和服务的新需求,也被称之为“银色经济”,其中就包括医疗技术和家庭医疗保健。这使得该领域的技术运用的更高效,同时也促使政府对其医疗预算实施更加严格的控制。 监管体系概况 日本的医疗器械由日本药品与医疗器械法(Pharmaceutical and Medical Device Act)进行监管。该法案在2014年11月25由原有的药事法(Pharmaceutical Affairs Law)修订而来。新的法案主要有以下5处更改,以确保药品与医疗器械的安全和加速供应: 1. 药品,医药部外品和化妆品的上市许可和生产许可开始分离。 2. 第三方认证机制放宽至“高度受控的医疗器械”,并制定了相应标准。 3. 用于诊断的单个计算机软件被归于医疗器械进行管理,且需要经过上市许可审批(在此之前,这一品类不在批准上市或核发执照范围以内)。 4. 医疗器械生产许可由审批制简化为注册制。 5. 对医疗器械的生产和质量控制的规范依从性审查进行了合理化修订。 最近,在2016年6月,隶属于药品安全及环境卫生局(PSEHB)的“医疗器械评价和许可部”建立,用于加强对医疗器械、体外诊断和再生医学产品的管理。这三类产品原本隶属的“评价和许可部”更名为“医药评价和许可部”,专注于对药品、医药部外品和化妆品的管理。 此外,厚生劳动省在2016年1月25日对正处于开发阶段的药品放宽了批准使用的门槛,这被称为日本版的“关怀计划”。在2016年7月,医疗器械和再生医学产品的GCP条例也被修订,以降低临床试验赞助方及研究者的负担,增加了进行扩大试验的可行性。 医疗器械分类 日本《药品与医疗器械法》第二章第四款对医疗器械的定义为:“被《药品与医疗器械法》指定的用于诊断、治疗或预防人或动物的疾病的器械和设备,或影响人或动物的身体结构或功能的器械和设备“。 医疗器械按照其风险大小被分成4个等级(见表1),其市场准入要求也按该等级分类监管。日本当局尚不接受欧盟的CE标准和美国的FDA标准,尽管欧盟和美国的认证有助于加速评审过程。
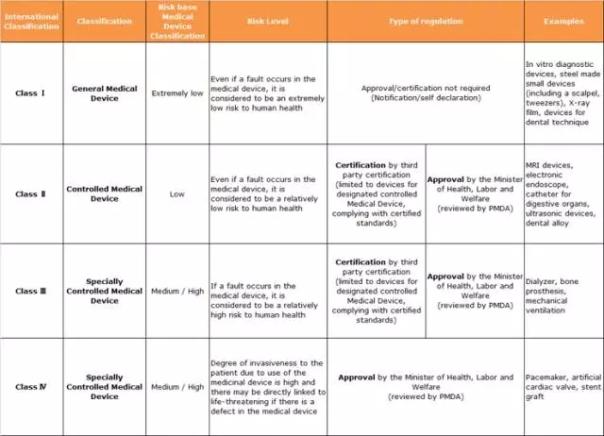
表1:日本医疗器械的分类、市场准入和风险控制(来源:Cortellis Regulatory Intelligence, PDMA) 除上述四个分类之外,还有一个名为“高度维护受控的医疗器械”的分类,针对于需要专业知识和技能对医疗器械进行的维护、修理或其他控制,如果处置不当会对疾病的诊断、治疗和预防产生潜在的风险。 临床试验 医疗器械临床试验的监管与药品一致。临床研究开始前30天的书面通告和在试验过程中的不良反应报告都需要严格执行,且需经过审查和监管。值得注意的是,日本将体外诊断产品归为药品,而大多数西方国家将其归类为医疗器械。 体外联合诊断是指可以帮助医生选择对患者最佳的治疗方案的检测,也被称为“个性化治疗”。厚生劳动省发布了一个关于体外联合诊断技术的通告,目的是推广使用相应的产品来加快其发展。在个体联合诊断技术的开发过程中,寻求药品和医疗器械管理局(PMDA)的咨询和建议是非常必要且受到推荐的。事实上,PMDA并不墨守成规的坚持指导原则中的所给出的方法。 审批流程 日本医疗器械的上市许可审批也类似于药品评审体系。医疗器械的生产许可在2014年从“许可制”变为了“注册制”。同样的,对在境外生产的医疗器械的监管体制也从“认证制”转为了“注册制”。 PMDA为提交评审的临床试验及其数据提供咨询并给出指导和建议,同时也负责对提交的监管资料进行审查。PMDA共设有三个“医疗器械办公室”对这些监管资料进行处理,他们根据产品的责任类别划分为:办公室I,办公室II和办公室III。 只有上市许可资质的持有者才能在日本市场上直接或间接的销售医疗器械。上市许可共有3个类别(图1)且必须每5年进行一次更新。上市许可由日本都道府县(省级单位)政府在持有者通过各类GxP合规审查后授予。
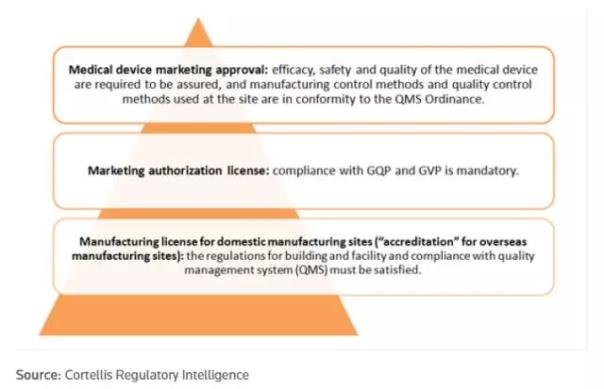
图1:日本医疗器械的许可与授权(来源:Cortellis Regulatory Intelligence, PDMA) 上市许可被分为三大类及若干子类:新型、仿制型和进口医疗器械,以便简化其审批流程。申请人在提交之前需要仔细核对以上三种分类。

图2:医疗器械的上市许可分类(来源:Cortellis Regulatory Intelligence) 同时,申请人需要提交符合规范的基于全球协调工作小组(Global Harmonization Task Force,GHTF)的技术文件总结(Summary Technical Documentation,STED)和申请文件及数据设置符合基本原则(EP)的一致性声明。 对于受控的医疗器械,一个基于第三方认证机构的认证系统是必要的,其中的第三方认证机构需要经过厚生劳动省认证其公平和公正性。受控医疗器械的申请人需要提交符合标准的申请文件。 对外国器械生产商的上市批准,需要外国器械生产商获得相应的上市许可持有人的授权。新批准和改进后批准的医疗器械列表可以在PMDA网站和审批报告网站上查询。 医疗器械的上市后的监管要求大多与药品监管要求相同。药品上市后的安全管控标准(GVP)在2014年颁布。上市许可持有人需要对产品的质量控制和上市后的安全管控负完全责任。GVP是获得上市许可的先决条件。 保险支付 一旦新的器械审批获准,必须同时向厚生劳动省提交该器械的保险支付请求。医疗器械和体外诊断产品的保险支付决定将由两个独立的机构进行认定,分别为医疗仪器委员会和日本中央社会保险医疗委员会(Chuikyo)。 保险支付系统共分有四个类别和若干子类,分别称为A、B、C和F(图3)。A类和B类适用于已有产品,C类和F类适用于新产品。其中,F类产品不被保险支付体系所覆盖。 为了被全民医保系统(A1,A2或B类)采纳,申请人必须确保其产品在进入该系统后能够立即供应市场。同时,法规规定,在产品更新换代直至被后续产品替代之前,原有的产品必须确保足够的供应。
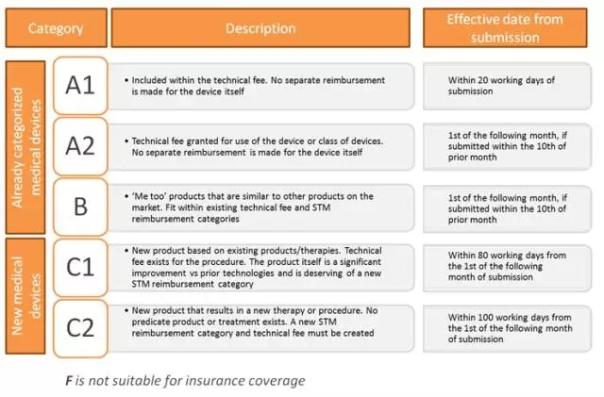
图3:医疗器械的保险支付类别(来源:Demystifying Device Reimbursement in Japan – Device Talk) 质量 在医疗器械的生产过程中,日本要求所有生产批次的质量都应该与通过审批的产品质量一致。为了确保此目的,生产场地应该有适当的生产设施,其生产过程和质量管理体系应得到正确维护和控制。 对于医疗器械和体外诊断产品,PMDA会在其申请阶段和上市后对包括日本境内和境外的生产场地进行现场核查和文件审查,以确保生产场地具有适当的设施且其生产过程和质量管理符合诸如质量管理体系(QMS)的标准,并拥有足以确保产品生产质量的管理系统。 结论 正如本文开头所述,日本是医疗器械生产者的重要市场。尽管日本当局在过去的几年中已经开始对其监管法规进行简化,但外国生产商想进入这个市场依然困难重重,尤其是日本尚不接受欧盟的CE和美国的FDA认证。所以,更好的理解其监管流程和市场障碍成为了节约时间,缩减成本和规避风险的关键。毫无疑问的是,再生医学和健康数字化领域由于其复杂性会在未来对医疗器械的监管环境产生影响,而制造商们将不得不调整自己的策略。
作者:科睿唯安 中文翻译:阿栗博士
|  /3
/3 