登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
摘要:美国食品药品监督管理局(Food and Drug Administration, FDA)于当地时间2014年10月3日公布了2013年度医疗器械质量体系数据。
此次的发布,FDA综合分析对比了医疗器械质量体系数据,包括所产生的483观察项和警告信来源。所分析的数据收集于2013年1月1日至2013年12月31日。FDA相信通过此次数据分享,可以帮助企业改善器械的质量、识别可能需要关注的领域和可能帮助企业避免收到警告信。
审厂情况关键分析点
2013年,质量体系的监督审厂数量相比减少了3%,这一减少可能来自于海外审厂数量的增加,海外的审厂需要动用FDA更多的资源。2013年,全部审查数量减少了17%。2012至2013年间,最常发生的观察项基本没有变化。存在的问题主要体现在以下方面:
l 纠正和预防措施程序 (21 CFR 820.100(a) )
l 投诉文件,特别是建立和维护程序接收、审查和评估的投诉(21 CFR 820.198(a) )
l 对确保质量体系应符合建立的质量体系的要求,以及确定质量体系的有效性的质量督查(21 CFR 820.22 )
警告信情况关键分析点
l 警告信的数量自2009年以来首次数量减少。有4%的被审查的国内企业和16%被审查的国外企业收到了警告信。
l 2013年度开出的警告信中,存在的问题主要体现在以下方面:
1)纠正和预防措施程序 (21 CFR 820.100(a) )
2) 投诉文件,特别是建立和维护程序接收、审查和评估的投诉(21 CFR 820.198(a) )
3) 质量督查程序(21 CFR 820.22).
l 2012年至2013年,CDRH统计出现在警告信中的设计历史的不符合项有所降低。2012年,五十分之一的警告信出现了21 CFR 820.184 法规下的设计历史文件的不符合项。2013年有44封警告信中包含了该不符合项。
审厂
该报告显示,在2008-2013年度间,FDA海外质量体系审厂次数占全部审厂比例逐年递增。由2008年的210次逐渐升至2013年的460次(图1 2008-2013年医疗器械例行质量体系监督审厂统计)。 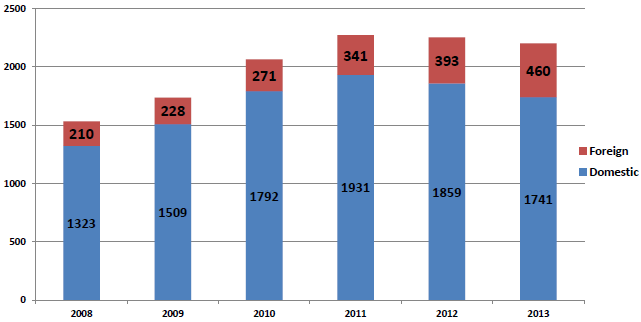
图1 2008-2013年医疗器械例行质量体系监督审厂统计
中国跃居FDA海外审厂次数排名第二位,2013年中国企业共发生82次审厂(表1 2013年国外审厂次数前十国家)。
表1 2013年国外审厂次数前十国家
国家 | | 德国 | | 中国 | | 加拿大 | | 法国 | | 日本 | | 韩国 | | 意大利 | | 瑞士 | | 瑞典 | | 爱尔兰 | |
2013年审厂次数总计为3534次,其中审查P&PC(生产和过程控制)的比例最高,为33%;CAPA(纠正和预防措施)的比例为31%,MGMT(管理控制)的比例为12%,DES(设计控制)的比例为14%,DOC(文件控制)的比例为10%(图2 2003-2012质量体系子系统审厂情况统计)。
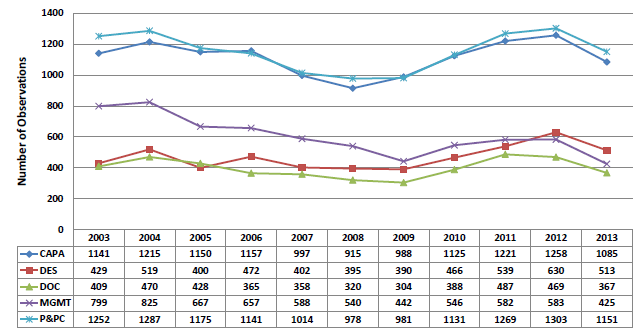
图2 2003-2012质量体系子系统审厂情况统计
警告信
报告显示,2013年FDA发布的警告信数量与2012年相比,有小幅下降,由2012年的164封减少至2013年的144封(表2 历年警告信发布数量)。
表2 历年警告信发布数量 年份 | | 2013 | | 2012 | | 2011 | | 2010 | | 2009 | | 2008 | | 2007 | | 2006 | | 2005 | | 2004 | |
2013年度,每个子系统的审查数量在整个审查中所占的比例见表3,可见P&PC和CAPA受审查次数最多。
表3 各子系统的审查数量统计 而在2013年度144封警告信中,也显示出CAPA和P&PC不合格情况居首的情况。每个子系统出现的不合格项所占比例见表4。
表4 各子系统出现的不合格项统计 2013年度警告信中,最高频率出现的不符合项有21 CFR 820.100(117次),21 CFR 820.198(112次),21 CFR 820.90(47次),共计276次。
l 设计控制子系统的不符合项前三位有21 CFR 820.30(g)(30次),21 CFR 820.30(i)(28次),21 CFR 820.30(a)(22次)。
l P&PC子系统的不符合项前三位有21 CFR 820.80(59次),21 CFR 820.70(57次),21 CFR 820.75(55次)。
l 管理控制子系统的不符合项共有21 CFR 820.22(52次),21 CFR 820.20(40次),21 CFR 820.25(20次)。
l 文件控制子系统的不符合项前三位有21 CFR 820.184(46次),21 CFR 820.40(36次), 21 CFR 820.181(22次)。
来源:FDA官网(奥咨达翻译)
|  /3
/3 