金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
在之前的分享中,小 M 为大家带来了“怎么做 Western blot? 看这一篇就够了!”和“WB 常见问题及解决方案”两篇推文。然而实际操作时,许多朋友发现仍会遇到各种各样的问题,本期小 M 跟您聊一聊 WB 的具体实操,以及每一个成功的 WB 实验背后容易被忽视,但却至关重要的小细节! 首先,我们来回顾下整个 WB 流程:蛋白样本制备 → 电泳 → 转膜 → 封闭 → 孵育一抗 → 孵育二抗 → 显影 → 分析。
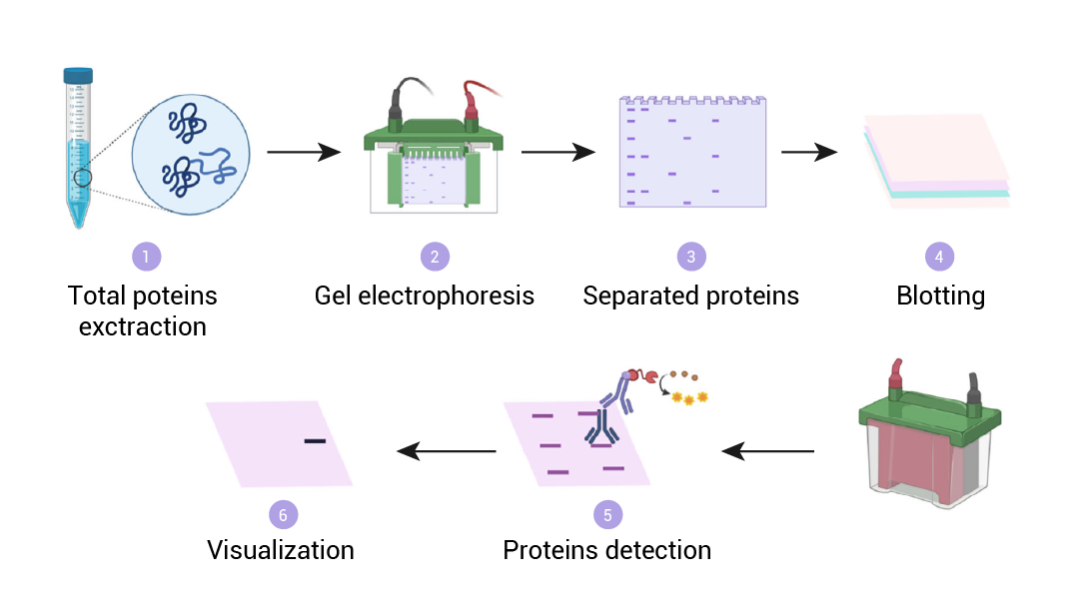
图 1. Western blot 的流程图[1]。
1 蛋白样本制备
1.1 总蛋白提取
(1) 准备溶液
室温融解蛋白裂解液 RIPA,加入蛋白酶磷酸酶抑制剂混合物 (10X),使最终浓度为 1X,混匀,立即放置在冰上。
(2) 不同样本
对于贴壁细胞: 4℃ 预冷的 PBS 洗 2~3 遍,用细胞刮子刮下细胞,或用胰蛋白酶处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
对于悬浮细胞:用 PBS 洗 2~3 遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
对于组织样品:剪取适量组织和适量混匀的蛋白裂解液于匀浆器中磨匀 (0.01 g 组织加上 50-100 μL 的蛋白裂解液),直至看不见组织块;
(3) 裂解 细胞样品按 1×106 细胞数加 100 μL 裂解液,冰上裂解 30 min (或冰上裂解 5 min,超声仪冰浴超声 20 s)。组织样品转移匀浆液于 1.5 mL EP 管中,置于冰上裂解 15 min;
(4) 抽提 12,000 rpm, 4℃ 离心 10 min,立即吸取上清至一预冷的 1.5 mL EP 管中,即为抽提得到的细胞浆蛋白。

1.2. BCA 蛋白浓度测定
(1)制备好 BSA 标准品,并将 BCA 试剂 A 液: B 液=50:1 配制适量 BCA 工作液,样品用预冷 PBS 进行稀释;
(2)将标准品和样品分别加到 96 孔板中;
(3)各孔加入 BCA 工作液,37 ℃ 孵育 30 min;
(4)酶标仪 562 nm 波长读取各孔 OD 值;
(5)根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
<hr/>2 电泳
2.1 制胶(使用预制胶板请忽略此步骤)
(1) 准备玻璃板,确保两块玻璃板下缘水平且均无豁口,安装时内长外短,用手压实玻璃板及垂直槽制胶架。
(2) 倾斜垂直槽制胶架子装入垂直槽制胶固定架,注意为防止胶片变形漏液体,不要过分用力下压,并确保卡好。
(3) 按照每块 5 mL 配制分离胶 (1 mm 厚度),轻轻混匀后立即铺板;(SDS-PAGE 凝胶配方详见“怎么做 Western blot? 看这一篇就够了! ”)
(4) 铺板后用异丙醇将分离胶液面压平;
(5) 凝固 40 min 后,吸干异丙醇。用 ddH2O 轻轻冲洗并吸干;
(6) 按照每块 1.5 mL 配制浓缩胶,并插上合适大小的梳子,注意操作要迅速且水平,不能产生气泡; (8) 40 min 浓缩胶凝固后从制胶架上拆下,用 ddH2O 将残留在胶板上的胶清洗干净,并用保鲜膜包裹住,立即使用或 4°C 储存。
2.2 制样
加入4×上样缓冲液混匀,100℃ 放置 10 min,迅速冰浴冷却;
2.3 跑胶
(1)根据 BCA 测定结果,目的蛋白每孔上样量 20 μg-40 μg,内参蛋白每孔上样量 5 μg-10 μg;
(2)电泳时上层胶使用低电压恒压电泳,80 V,约 30 min;
(3)溴酚蓝进入下层胶时使用高压恒压电泳,120 V,至溴酚蓝到达胶的底端处附近即可停止电泳。

3 转膜(湿转)
转膜步骤:
(1) 准备转膜缓冲液:
提前配制好转移缓冲液并预冷至 4 ℃;
(2) 准备 PVDF 膜和滤纸:
将 PVDF 膜在甲醇中浸泡 30 s (从不透明变为半透明),接着用 ddH2O冲洗膜表面,最后将膜和滤纸放入转膜缓冲液中;
(3) 处理凝胶:
轻轻撬开玻璃板,切掉浓缩胶和周围不需要的区域。将凝胶放入转膜缓冲液中,确保胶的完整性;
(4) 制备转膜“三明治”:
三明治夹套的黑色面向下,透明面 (或红色面) 朝上打开放置在干净的桌面上。从下依次往上放置海绵、滤纸、凝胶、PVDF 膜、滤纸、海绵。确保每一层之间都没有气泡,可以在放置最上层泡沫垫前使用滚轮轻轻滚动,以去除气泡;
(5) 转膜:
将夹套插入转移电泳芯中,确保黑色板朝向黑色板。然后将转移电泳芯放入转膜槽中,加入足够的转膜缓冲液,确保夹套完全浸没在缓冲液中。设置转膜电流为恒流,220 mA,根据蛋白大小不同设置转膜时间 (一般 30 kDa 以下转 30 min,30-70 kDa 转 60-90 min,70-150 kd 转 90-180 min); (6) 转膜后处理: 转膜完成后,取出 PVDF 膜,用 TBST 冲洗膜表面,进行封闭等后续步骤。

4 封闭
室温下,将转好的膜于摇床上用 5% 的脱脂牛奶 (TBST 配制),磷酸化蛋白检测用 5% 的 BSA (TBST 配制) 缓冲液,室温封闭 1-2 h。
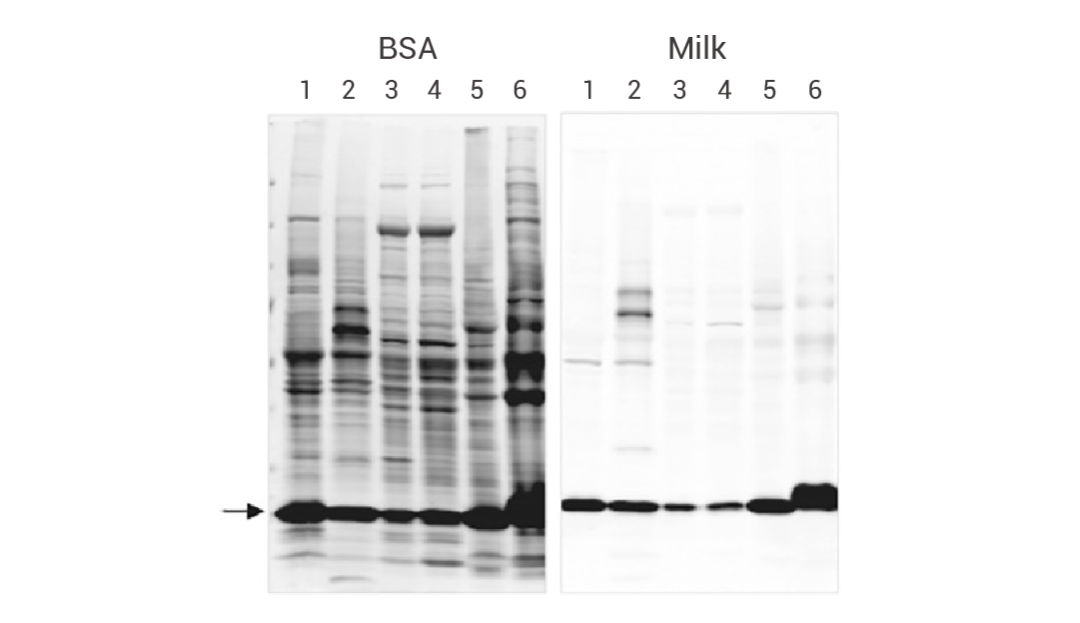
封闭液的主要作用是占据非目标结合位点,降低背景信号,从而提高检测的特异性和灵敏度。常用的封闭液:脱脂奶粉、牛血清白蛋白 (BSA)。那么封闭液应该如何选择呢?

5 抗体孵育
(1) 孵育一抗:稀释一抗 (TBST 溶解的 5 % 脱脂牛奶,磷酸化蛋白使用 TBST 溶解的 5% BSA),4℃ 过夜孵育。
(2) 洗膜:按照 3 次 TBST 进行洗膜,每次 5 min。
(3) 孵育二抗:一般使用 TBST 溶解的 5% 脱脂牛奶,磷酸化蛋白使用 TBST 溶解的 5% BSA 室温孵育 1-2 h。
(4) 洗膜:按照 3 次 TBST,1 次 TBS 进行洗膜,每次 10 min。
MCE 内参抗体特别推荐

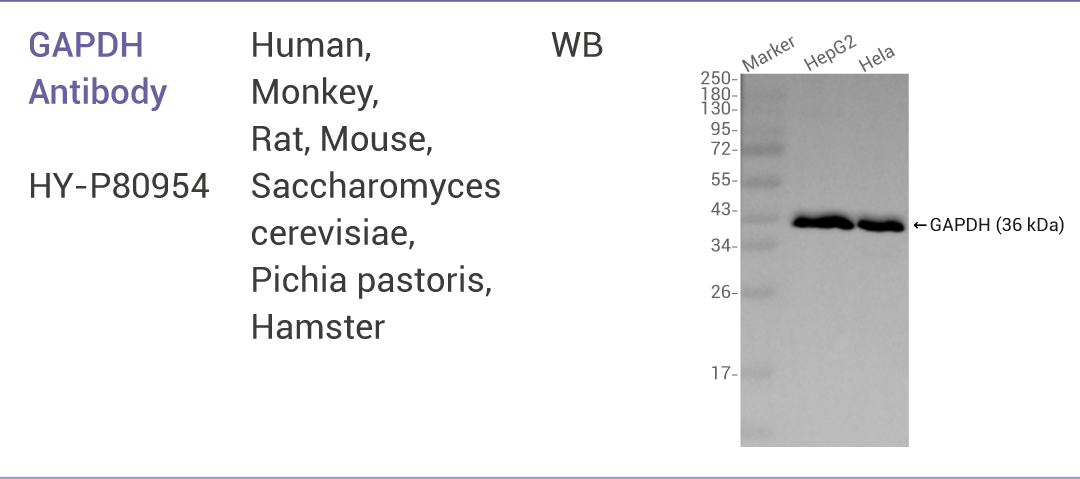
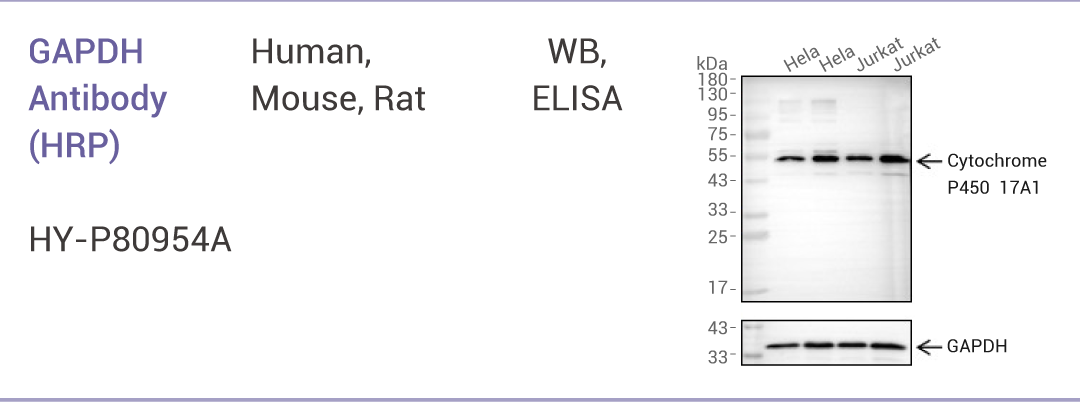

5.1 内参抗体选择标准
内参在实验中扮演着至关重要的角色,想要挑选出靠谱的内参抗体?
你需要遵循以下三个法则:
5.1.1 样本来源与特性
1. 样本种属来源:哺乳动物样本可选择 GAPDH、β-Actin 等;植物样本则选择 Plant Actin、Rubisco 等;
对于研究较少的样本类型,可查阅相关文献以获取合适的内参蛋白推荐。例如:Shiyang Li 等人发现 gatB 基因是猪肺炎支原体最合适内参基因[4]。
2. 样本组织特性:不同组织细胞的结构和功能有所差异,应选择在该组织中稳定表达的蛋白作为内参。
5.1.2 目的蛋白定位



















5.1.3 目的蛋白分子量
为了确保目的蛋白与内参蛋白能够清晰区分,所选内参蛋白的分子量应与目的蛋白相差至少 5 kDa 以上。(方便在同一张膜上同时孵育内参抗体与目的蛋白抗体,更精确地反映样本间的表达差异)
举例来说,当目的蛋白的分子量为 45 kDa 时,可以优先选择 GAPDH 或 β-Tubulin。GAPDH 的分子量约为 36 kDa,与 45 kDa 的目的蛋白相差足够大,可以清晰地区分开。
<hr/>Tips
需要注意的是,没有一种内参适用于所有组织和细胞,以下是小 M 为大家整理的一些特殊情况[5]。
1. 组织特异性内参选择
(1)脂肪组织:β-Actin 的表达量非常低,不适合作为内参。
(2)多组织多细胞样本对比:GAPDH 作为代谢类蛋白,在活组织中表达比较恒定,因此多组织多细胞样本对比时,建议选用 GAPDH 作内参[6]。β-Actin 和 β-Tubulin 等结构蛋白在不同组织中会有表达差异。
2. 修饰型蛋白检测时的内参选择
检测磷酸化、乙酰化等修饰型蛋白:β-actin 和 β-Tubulin 等结构蛋白表达相对稳定;
3. 疾病或处理条件下的内参选择
(1) 缺氧、糖尿病模型、肿瘤组织:GAPDH 表达增高,不适合作为内参[7]。(2) 抗癌和真菌药物处理:Tubulin 表达受影响,不适合作为内参。
4. 细胞功能或状态变化时的内参选择
(1)细胞增殖实验:c-Jun 自身表达会变化,不适合作为内参[8]。
(2)凋亡实验:TBP、Lamin 在凋亡过程中表达或定位会变化,不适合作为核内参。
5. 特殊组织类型的内参选择
骨骼肌、心肌、平滑肌:Tubulin 表达改变和特化,不适合作为内参。
6. 特殊样本类型的内参选择
血浆、乳汁、组织液等分泌样本:由于没有完整的细胞结构,可选择分泌型蛋白如 Transferrin 作内参。

6 ECL 显影
6.1 显影步骤:
(1) 在避光环境中,将 ECL 化学发光试剂 A 液、B 液 1:1 配置,充分混匀;
(2) 将 PVDF 膜置于化学发光成像仪载物台上;
(3) 用移液器吸取适量 ECL 混合液滴在 PVDF 膜上,确保工作液均匀覆盖在整张印迹膜上;
(4) 推入载物台,设置曝光时间进行图片采集 (可设置不同的曝光时间采集图像,从中选取曝光效果最佳的图像)。
WB 实验虽然看似简单,但其中蕴含的学问却不少。只有当我们真正掌握了每一个细节,并严格按照实验步骤进行操作时,才能获得准确、可靠的结果。希望今天的分享能够为大家在 WB 实验的道路上提供一些帮助~最后,小 M 衷心祝福使用 MCE 抗体产品的科学汪们: 高分文章发不停,基金中到数不清! <hr/>相关产品
Beta Actin Antibody
Actin 是细胞的一种重要骨架蛋白,基本上存在于所有真核细胞中。其氨基酸序列高度保守,在进化过程中几乎没有变化。
Beta Actin Antibody (HRP)
Actin 是细胞的一种重要骨架蛋白,基本上存在于所有真核细胞中。其氨基酸序列高度保守,在进化过程中几乎没有变化。
GAPDH Antibody
GAPDH(甘油醛-3-磷酸脱氢酶)是参与糖酵解的一种关键酶,几乎在所有组织中都高水平表达。
GAPDH Antibody(HRP)
GAPDH(甘油醛-3-磷酸脱氢酶)是参与糖酵解的一种关键酶,几乎在所有组织中都高水平表达。
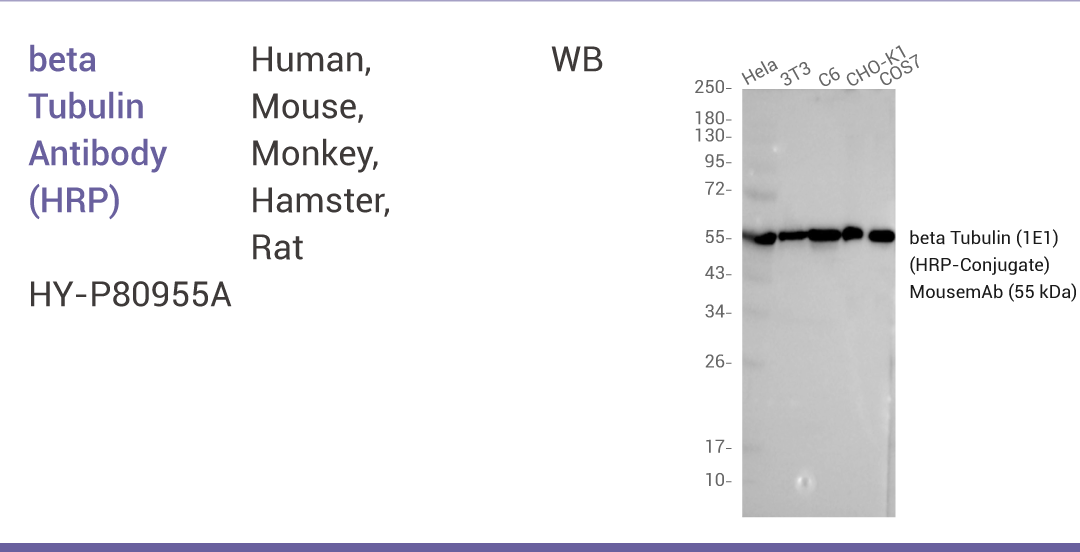
beta Tubulin Antibody
Tubulin 即微管蛋白,是细胞骨架的主要成分之一。
beta Tubulin Antibody (HRP)
| Tubulin 即微管蛋白,是细胞骨架的主要成分之一。 | | Histone H3 AntibodyHistone H3 是核小体的核心成分,常作为细胞核内参。 | | ATP1A1 AntibodyATP1A1 是位于细胞膜上的糖蛋白,也是钠钾 ATP 酶的一个关键组成部分。 | | VDAC1 AntibodyVDAC1 是线粒体外膜上一种重要的跨膜蛋白,在调节细胞生存和维持细胞内外环境平衡方面扮演着重要角色。 | | LAMP2LAMP2 存在于溶酶体膜,在细胞自噬、溶酶体功能以及多种生理和病理过程中都发挥着重要作用。 |
Histone H3 Antibody
| Tubulin 即微管蛋白,是细胞骨架的主要成分之一。 | | Histone H3 AntibodyHistone H3 是核小体的核心成分,常作为细胞核内参。 | | ATP1A1 AntibodyATP1A1 是位于细胞膜上的糖蛋白,也是钠钾 ATP 酶的一个关键组成部分。 | | VDAC1 AntibodyVDAC1 是线粒体外膜上一种重要的跨膜蛋白,在调节细胞生存和维持细胞内外环境平衡方面扮演着重要角色。 | | LAMP2LAMP2 存在于溶酶体膜,在细胞自噬、溶酶体功能以及多种生理和病理过程中都发挥着重要作用。 |
ATP1A1 Antibody
| Tubulin 即微管蛋白,是细胞骨架的主要成分之一。 | | Histone H3 AntibodyHistone H3 是核小体的核心成分,常作为细胞核内参。 | | ATP1A1 AntibodyATP1A1 是位于细胞膜上的糖蛋白,也是钠钾 ATP 酶的一个关键组成部分。 | | VDAC1 AntibodyVDAC1 是线粒体外膜上一种重要的跨膜蛋白,在调节细胞生存和维持细胞内外环境平衡方面扮演着重要角色。 | | LAMP2LAMP2 存在于溶酶体膜,在细胞自噬、溶酶体功能以及多种生理和病理过程中都发挥着重要作用。 |
VDAC1 Antibody
| Tubulin 即微管蛋白,是细胞骨架的主要成分之一。 | | Histone H3 AntibodyHistone H3 是核小体的核心成分,常作为细胞核内参。 | | ATP1A1 AntibodyATP1A1 是位于细胞膜上的糖蛋白,也是钠钾 ATP 酶的一个关键组成部分。 | | VDAC1 AntibodyVDAC1 是线粒体外膜上一种重要的跨膜蛋白,在调节细胞生存和维持细胞内外环境平衡方面扮演着重要角色。 | | LAMP2LAMP2 存在于溶酶体膜,在细胞自噬、溶酶体功能以及多种生理和病理过程中都发挥着重要作用。 |
LAMP2
| Tubulin 即微管蛋白,是细胞骨架的主要成分之一。 | | Histone H3 AntibodyHistone H3 是核小体的核心成分,常作为细胞核内参。 | | ATP1A1 AntibodyATP1A1 是位于细胞膜上的糖蛋白,也是钠钾 ATP 酶的一个关键组成部分。 | | VDAC1 AntibodyVDAC1 是线粒体外膜上一种重要的跨膜蛋白,在调节细胞生存和维持细胞内外环境平衡方面扮演着重要角色。 | | LAMP2LAMP2 存在于溶酶体膜,在细胞自噬、溶酶体功能以及多种生理和病理过程中都发挥着重要作用。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
<hr/>参考文献
[1] Pillai-Kastoori L, et al. Antibody validation for Western blot: By the user, for the user. J Biol Chem. 2020 Jan 24;295(4):926-939.
[2] Li S, et al. Selection of internal reference gene for normalization of reverse transcription-quantitative polymerase chain reaction analysis in Mycoplasma hyopneumoniae. Front Vet Sci. 2022 Jul 22;9:934907.
[3] Ferguson RE, et al. Housekeeping proteins: a preliminary study illustrating some limitations as useful references in protein expression studies. Proteomics. 2005 Feb;5(2):566-71.
[4] Ren G, et al. Selection and validation of reference genes for qPCR analysis of differentiation and maturation of THP-1 cells into M1 macrophage-like cells. Immunol Cell Biol. 2022 Nov;100(10):822-829.
[5] Kalezic A, et al. Tissue-Specific Warburg Effect in Breast Cancer and Cancer-Associated Adipose Tissue-Relationship between AMPK and Glycolysis. Cancers (Basel). 2021 May 31;13(11):2731.
[6] Wu Y, et al. Overexpression of Krüppel-Like Factor 4 Suppresses Migration and Invasion of Non-Small Cell Lung Cancer Through c-Jun-NH2-Terminal Kinase/Epithelial-Mesenchymal Transition Signaling Pathway. Front Pharmacol. 2020 Jan 8;10:1512.
[7] Meftahi GH, et al. Applications of western blot technique: From bench to bedside. Biochem Mol Biol Educ. 2021; 49: 509– 517.
[8] Taylor SC, Posch A. The design of a quantitative western blot experiment. Biomed Res Int. 2014:361590. |
|
 /3
/3 