登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
CFDA医疗器械法规整体流程:
法规背景:
• 自2014年10月1日起,凡新开办医疗器械生产企业、现有医疗器械生产企业增加生产第三类医疗器械、迁移或者增加生产场地的,应当符合医疗器械生产质量管理规范的要求。 • 自2016年1月1日起,所有第三类医疗器械生产企业应当符合医疗器械生产质量管理规范的要求。 • 自2018年1月1日起,所有医疗器械生产企业应当符合医疗器械生产质量管理规范的要求。 体外诊断试剂质量管理体系核查要点——法规要求
ü 需要进行质量体系考核的情况: • 适用于医疗器械注册现场核查 • 医疗器械生产许可(含延续或变更)现场检查 • 以及根据工作需要对医疗器械生产企业开展的各类监督检查 重点项(*) | | | | | | | | 仅存在一般项目不符合要求,且不对产品质量产生直接影响的,建议结论为“整改后复查” | | | 对产品质量产生直接影响的,建议结论为“未通过检查” | | | | |
检查结论为“整改后复查”的企业应当在现场检查结束后的规定时限内[其中注册核查在6个月内,生产许可(含变更)现场检查在30天内]完成整改并向原审查部门一次性提交整改报告,审查部门必要时可安排进行现场复查
总计:218项,其中一般项176项,重点项42项
体外诊断试剂质量管理体系核查要点---机构与人员
• 组织机构图
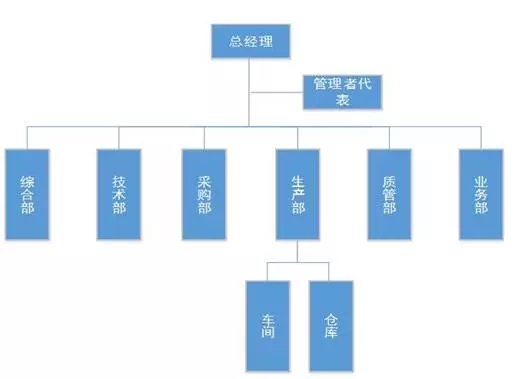
Ø 人力资源的配置 Ø 管理者在质量管理工作的地位 Ø 岗位职责权限的分配 • 人员岗位的要求 企业负责人----产品质量的主要责任人——质量方针,质量目标,管理评审,指派(任命)管理者代表 管理者代表----全面负责医疗器械质量管理工作的企业高级管理人员——学历,工作经验,企业的岗位职称,保证质量体系有效运行 各个地方已经出台相应的管理者代表的管理办法: 湖北,广东,福建,上海,湖南,北京等地。 生产,质量,技术(研发)管理人员——法规知识熟悉,学历专业的要求(医学,检验学,生物学,免疫学,药学),实践经验 任职要求:专业要求,工作经验,岗位要求。岗位考核! 检验人员——专业知识,岗位要求,工作技能(自行规定) 其他从事与质量工作人员的人员都应该进行岗位说明。(如生产操作人员,采购,库管等) Ø 培训 生产人员岗位操作培训、检验人员岗位操作培训——一定要求实操培训 其他培训:卫生和微生物基础知识培训、洁净区工作操作培训、安全防护培训、高风险(生物活性材料,高毒性,传染性,致敏性) 培训档案的建立:培训申请,培训计划,培训记录(签到,培训效果小结),培训试卷,培训教材等。 人员资质:
体外诊断试剂质量管理体系核查要点解析---厂房与设施
Ø 厂房设计要求 • 厂房设施应当符合产品生产要求: 诊断试剂产品按风险程度的分类 • 第一类产品:
1.微生物培养基(不用于微生物鉴别和药敏试验);
2.样本处理用产品,如溶血剂、稀释液、染色液等。 • 第二类产品:
1.用于蛋白质检测的试剂;
2.用于糖类检测的试剂;
3.用于激素检测的试剂;
4.用于酶类检测的试剂;
5.用于酯类检测的试剂;
6.用于维生素检测的试剂;
7.用于无机离子检测的试剂;
8.用于药物及药物代谢物检测的试剂;
9.用于自身抗体检测的试剂;
10.用于微生物鉴别或者药敏试验的试剂;
11.用于其他生理、生化或者免疫功能指标检测的试剂。 第三类产品 1.与致病性病原体抗原、抗体以及核酸等检测相关的试剂; 2.与血型、组织配型相关的试剂; 3.与人类基因检测相关的试剂; 4.与遗传性疾病相关的试剂; 5.与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂; 6.与治疗药物作用靶点检测相关的试剂; 7.与肿瘤标志物检测相关的试剂; 8.与变态反应(过敏原)相关的试剂。 • 厂房硬件条件需求 非洁净厂房:一般清洁环境 (不含生物活性材料产品如无机离子类试剂) • 洁净区内表面(墙面,地面,天棚、操作台)应当平整光滑,无裂缝、接口严密,无颗粒物脱落,避免积尘,并便于清洁处理和消毒。 • 墙面:岩棉板或泡沫板 地面:环氧树脂自流平、PVC卷材、聚氨酯地面 • 厂房设施应当符合要求: • 洁净区和非洁净区之间应有缓冲设施 注意:人流入口(图1)和物流入口(图2) 图一 图2 Ø 关于生产聚合酶链式反应(PCR)试剂的检验和生产应当在独立的建筑物或空间内,保证空气不直接联通,防止扩增时形成的气溶胶造成交叉污染。 Ø PCR检验室有独立的设计要求 缓冲间为负压的理想PCR实验室设置模式 缓冲间为正压的理想PCR实验室设置模式 • 阴性或阳性血清、质粒或血液制品的处理操作,生产区域应不低于万级,并应当与相邻区域保持相对负压。 • 无菌物料的分装处理操作区域应当符合局部百级洁净度级别 • 生产激素,操作有致病性病原体或芽孢菌制品应当使用单独的空调净化系统,与相邻的区域保持负压,排出的空气不能循环使用。 Ø 明确要求人流,物流包装线与其他一般品种生产线不能共用。 • 现场体系考核,生产,质检,研发场地往往都是首先被检查,检查过程一定要注意细节,在日常工作中建立良好的规范操作。
来源:致众医疗器械资讯
|  /3
/3 