金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|

楼主 |
发表于 2016-1-4 14:18
|
显示全部楼层
有关创新医疗器械申请的Q&A
Q:可以在什么网站上查询专利呢?
A:博济医药推荐国家知识产权局官网的专利检索与查询入口:http://www.sipo.gov.cn/zljsfl/
Q:必须是在中国取得或公开的专利吗?国外的可以吗?
A:必须是中国的专利。不过,现在越来越多的境外企业在申请专利时会选择PCT途径递交国际专利申请,向多个国家申请专利,所以跨国企业在中国取得专利权的情况并不鲜见。
Q:必须是发明专利吗?实用新型可以吗?
A:专利分为发明专利、实用新型和外观设计三类。在《创新医疗器械特别审批程序(试行)》(以下简称《程序》)中,明确表示为“核心技术发明专利权”,所以只能是发明专利。
Q:取得专利权后,才能申请走创新通道吗?
A:不是。在《程序》中表明可以为“取得”或“公开”专利两种情况。在这里博济医药普及一下专利的申请过程:申请专利→初步审查→公开专利申请→三年内经申请人请求后,进入实质审查程序→合格后授予专利。所以,“公开”比“取得”专利的门槛低很多。
附:《专利法》第三十四条:“国务院专利行政部门收到发明专利申请后,经初步审查认为符合本法要求的,自申请日起满十八个月,即行公布。国务院专利行政部门可以根据申请人的请求早日公布其申请。
据有关人士透露,在申请日当天即能请求公开,广大企业可以利用这一点尽快实现公布专利。据调查,北京华脉泰科医疗器械有限公司的“腹主动脉覆膜支架系统”(公示期:2015年8月11日至2015年8月24日),其对应的专利《一种腹主动脉覆膜支架》的申请日为2014.12.11,公布日为2015.03.11,只用了4个月就完成了专利公布,当然还有比这个还快的案例。
Q:专利权是申请创新通道的必要条件还是充分条件?
A:当然是必要非充分条件。除了专利方面的要求,CFDA还要求申报产品必须具有两大亮点,即技术上处于国际领先水平,并且具有显著的临床应用价值。
Q:进展到什么阶段可提出创新医疗器械申请?
A:已完成产品的前期研究并具有基本定型产品。对是否完成型式检验和临床试验没有要求。
Q:和常规的注册申报资料想必,创新医疗器械申请需要提交哪些特别的资料:
A:在《程序》第四条中列出了所需提交的资料,其中以下两款属于特别之处:
(二)产品知识产权情况及证明文件。
(五)产品创新的证明性文件,至少应当包括:
1.信息或者专利检索机构出具的查新报告;
2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
3.国内外已上市同类产品应用情况的分析及对比(如有);
4.产品的创新内容及在临床应用的显著价值。
所以,专利、查新报告和相关文献是三项最基础的要求。
Q:创新医疗器械的申请程序是怎样的?
A:请见下方图示:
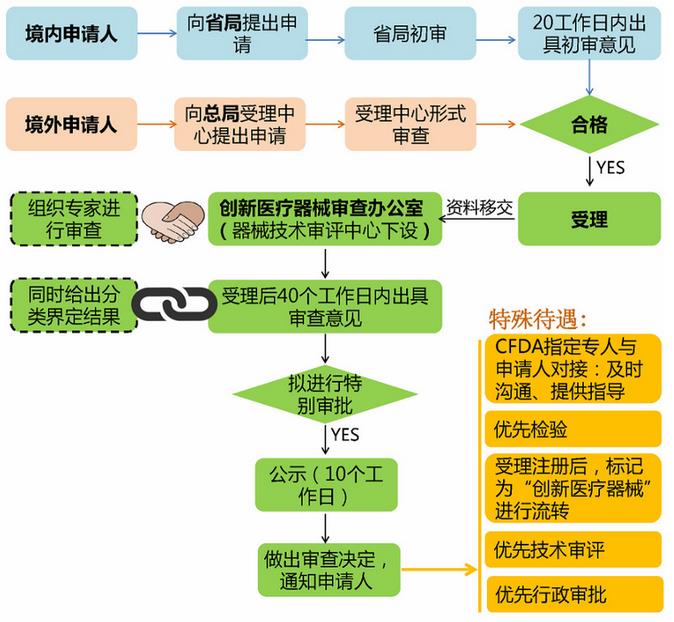
Q:创新医疗器械申请流程需要多长时间?
A:由上图可以看出,受理后50个工作日即可得到审查决定。对于境内申请人而言,要增加受理前省局初步审查的时间(20个工作日),总计70个工作日。(注:《程序》中未对省级向受理中心,以及受理中心向创新医疗器械审查办公室的资料流转时间做出规定,所以总共所需的时间应当在前面的基础上增加一些时日。)
Q:确认为创新医疗器械后,多长时间能拿到注册证?
A:取决于两个方面:1)受理前的资料准备时间(取决于申请人何时完成注册检验、临床试验等(如需));2)注册审评审批时间。
例:博奥生物集团有限公司的“恒温扩增微流控芯片核酸分析仪”的公示期为2015年2月3日~2015年2月15日,2015年4月20日即取得注册证,从公示到取证只用了短短两个月时间,为此CFDA还单独在其官方上发文公诸于众(参:《恒温扩增微流控芯片核酸分析仪获批》 2015年5月5日)。由此推测,CFDA方面的审评审批流程总时限可以由原来的128个工作日(三类产品,不含补充资料与质量管理体系核查时间)压缩到两个月左右时间(甚至可能更快)。
Q:创新医疗器械在临床试验上是否有优待呢?
A:《程序》中没有针对临床试验提供任何便利。
第十五条 创新医疗器械的临床试验应当按照医疗器械临床试验相关规定的要求进行,食品药品监督管理部门应当根据临床试验的进程进行监督检。
小编推测,一方面的原因是临床试验时间很大程度上取决于有没有合适的病人及受试者入组快慢,这不是CFDA一声令下就能加快的;另外一方面也取决于临床试验机构的配合程度——虽然临床试验机构的资质认定和复核工作由CFDA负责,不过医院们总体上还是归卫计委管辖,还承担着大量的临床工作,CFDA想要给创新医疗器械提供便利也有些力所不及啊。所以,博济医药建议广大企业,如需开展临床试验的话,就不要等着取得创新医疗器械认定结果及其带来的优先检验待遇了;不管是否能走绿色通道,早检验、早开展临床试验才是明智之选。
看到以上信息,广大医疗器械企业是不是在考虑对研发加大投入了呢?“大众创业、万众创新”不只是总理的一句口号,它的背后是各项扶持政策的出台和落实。在医疗器械领域,《创新医疗器械特别审批程序(试行)》的实施即是最有力的说明。博济医药希望和广大企业共同努力,让越来越多的创新医疗器械在国内外成功注册和上市销售。
原创:博济医药
|
|
 /3
/3 