登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
1.为什么退审风险越来越大? 2013年5月22日,总局医疗器械技术审评中心(CMDE)发布《关于医疗器械注册审评补充资料有关事宜的公告》(下称《公告》),其中明确指出:自2013年6月1日起,审评中心对医疗器械注册审评补充资料严格执行“一次性发补”,对于未按规定补充资料的申请将给与“终止审查”或“不予注册”的建议。 2014年10月1日实施的《医疗器械注册管理办法》(2014年总局令第4号)第二十八条规定:“技术审评机构应当一次告知需要补正的全部内容。申请人应当在1年内按照补正通知的要求一次提供补充资料……申请人逾期未提交补充资料的,由技术审评机构终止技术审评,提出不予批准的建议,国家食品药品监督管理总局核准后作出不予批准的决定。”
截至目前,“一次发补”已实施1年8个月,“退审”数量有何变化? 退审数量同比增长了68.58%。《公告》实施前连续12个月(2012年6月至2013年5月)审评中心发布的退审产品数量为541个;而《公告》实施后连续12个月(2013年6月至2014年5月)CMDE发布的“不予注册”产品数量为912个。
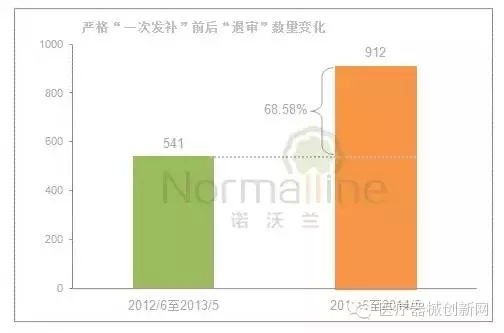
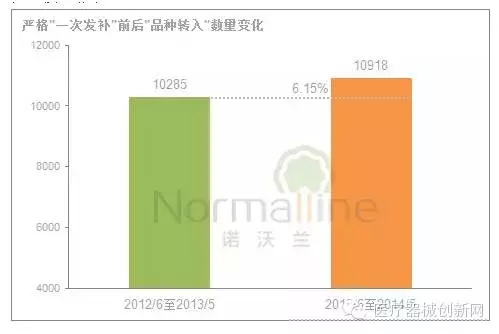
影响“退审”数量变化的主要因素: 严格“一次发补”要求、申请数量、递交资料质量及审评员的审评尺度等。 2012年6月至2014年5月这24个月,申报资料要求与技术审评相关法规均未发生较大变动,因此这两个因素对于“退审”的影响较小。那么,同期产品申报数量呢?仅上涨了6.15%。
这一时期,“发出补充通知”数量有何变化?这一数值下降了13.64%。
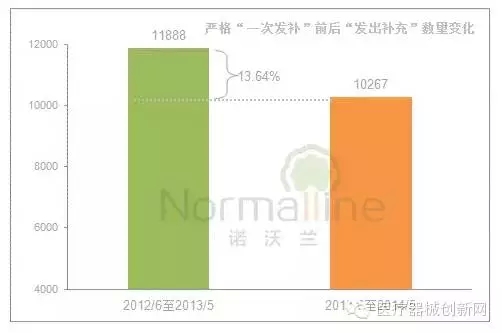
而另一个检验“一次发补”执行情况的关键指标,是同一时期“发出补充通知”和“品种转出”数量的比值。这个比值越接近“1”,说明“一次发补”的执行效果越好。《公告》实施前12个月发出补充与品种转出的比值为1.36,而此后12个月的比值降至1.01。可见,“一次发补”的执行效果良好。
看了上面的数据是否觉得,这跟我有啥关系?别着急,马上就有关系了。“退审产品数量”与“品种转出数量”可以体现“退审率”。“一次发补”实施前后连续24个月的数据告诉我们,“退审率”从6%增加到了9%。也许你会说这也没什么嘛,100份资料里仅仅增加了3个倒霉蛋。但2014年6月1日,《医疗器械监督管理条例》、《注册管理办法》等规章陆续实施后,我们前面假设无变化的“递交资料质量”及“审评员审评尺度”两个因素也会产生较大波动。这就意味着“退审数量”的更大波动哦~~~
2.哪些原因将导至退审? 依据《医疗器械注册管理办法》(总局令第4号)将导至食品药品监督管理部门作出不予注册的决定的原因包括以下6种: 1、申请人逾期未提交补充资料的; 2、申请人对拟上市销售医疗器械的安全性、有效性进行的研究及其结果无法证明产品安全、有效的; 3、注册申报资料虚假的; 4、注册申报资料内容混乱、矛盾的; 5、注册申报资料的内容与申报项目明显不符的; 6、技术审评机构应当一次告知需要补正的全部内容。申请人应当在1年内按照补正通知的要求一次提供补充资料……申请人逾期未提交补充资料的,由技术审评机构终止技术审评,提出不予批准的建议,国家食品药品监督管理总局核准后作出不予批准的决定。 当然还有托底条款“不予注册的其他情形。”
3.退审后多久可以重新申请该产品注册? 各位RA工作人员熟悉的16号令第二十五条规定:“注册申请被终止审查的,在被终止审查后的6个月内不得再次申请。”而在4号令中并未找到对应条目,这是否意味着注册人收到不予注册决定后,递交同一产品的注册申请不再受时间限制。
但是,需提请各位注意的是:依据《医疗器械监督管理条例》(国务院令第650号)第六十五条之规定:“提供虚假资料或者采取其他欺骗手段取得医疗器械注册证、医疗器械生产许可证、医疗器械经营许可证、广告批准文件等许可证件的,由原发证部门撤销已经取得的许可证件,并处5万元以上10万元以下罚款,5年内不受理相关责任人及企业提出的医疗器械许可申请。”关于此条仅适用于已取得医疗器械注册证的情形,还是同样适用于因提供虚假资料而导至的不予注册情形,需总局的进一步解释。
4.退审后怎么办? 退审后,申请人享有的权利 退审发生后,申请人享有申请复审和依法申请行政复议或者提起行政诉讼的权利。另外,依据国家食品药品监督管理总局医疗器械技术审评中心2009年发布的相关规定,申请人享有索回部分注册申报资料的权利。返还资料仅包括医疗器械注册证原件及生产质量体系考核报告原件。
2014年10月1日《医疗器械注册管理办法》等系列配套文件实施后,生产质量体系考核报告原件不再作为注册申报资料,而医疗器械延续注册/变更注册时也只需递交医疗器械注册证复印件。因此,申请人是否仍享有索回部分注册申报资料的权利有待药监总局的进一步解释。
不予退回的申报资料,如何递交? 依据上文可知,申报资料中的多数是不予退还的,那么这部分资料如何进行再申请呢?以检测报告为例,2013年国家食品药品监督管理总局行政受理中心曾明确:“对于退审后再次申报的医疗器械注册申请,申报时可提交原注册检测报告复印件作为本次注册时申报的注册检测报告。生产企业应对申报项目为退审后再次申报的情形进行说明,并提交该检测报告复印件与原件一致的声明。”当然,申请人还应注意申报资料本身的有效期。
针对退审的说明性文件 对于退审后再次申请的相关问题,行政受理中心在2010年曾针对“重新注册退审后再次申请”发表声明:“企业在符合重新注册申报资料的前提下,应对退审意见中提出的和涉及的有关问题予以补充和完善,并提交针对退审意见逐项完善的说明和相应的支持性资料。”
退审后的基本应对步骤 综上所述,退审后常规操作步骤为:1、明确退审后自身享有的权利;2、分析退审原因,作出决策;3、确定重新申请/申请复审/行政复议/行政诉讼时间,制定项目计划,筹备相关资料。 (资料来源CMDRA,医疗器械创新网整理汇编)
|  /3
/3 