登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
2015年7月3日,国家食品药品监督管理总局发布了《临床试验备案有关事宜的公告》(2015年第87号),以下是对该公告进行的“5W1H1S”概要分析(后附《公告》全文):

国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(2015年第87号) 根据《医疗器械监督管理条例》的规定,开展医疗器械临床试验应当备案。现将备案有关事宜公告如下:
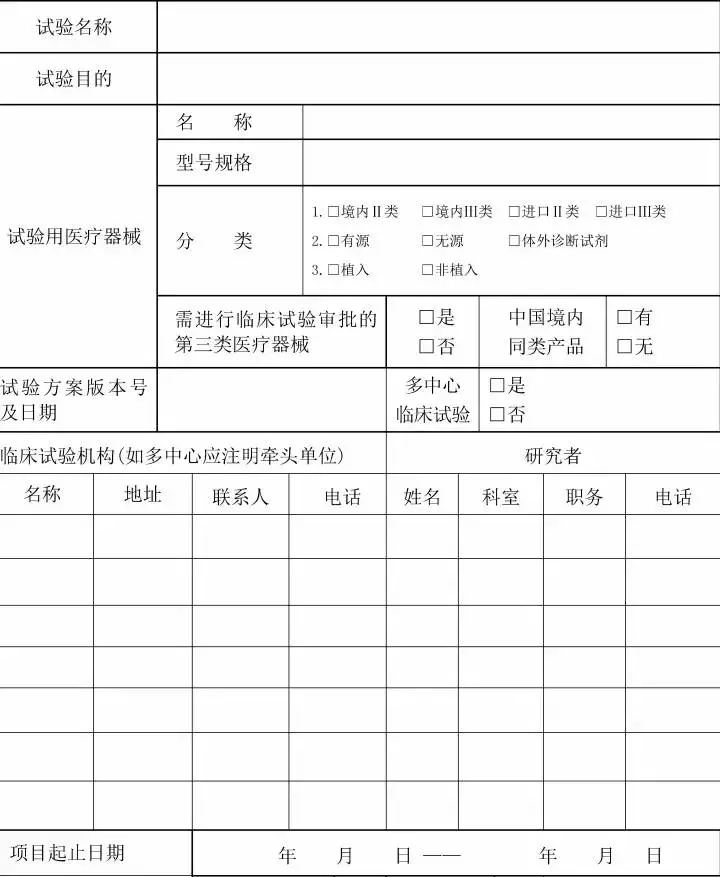
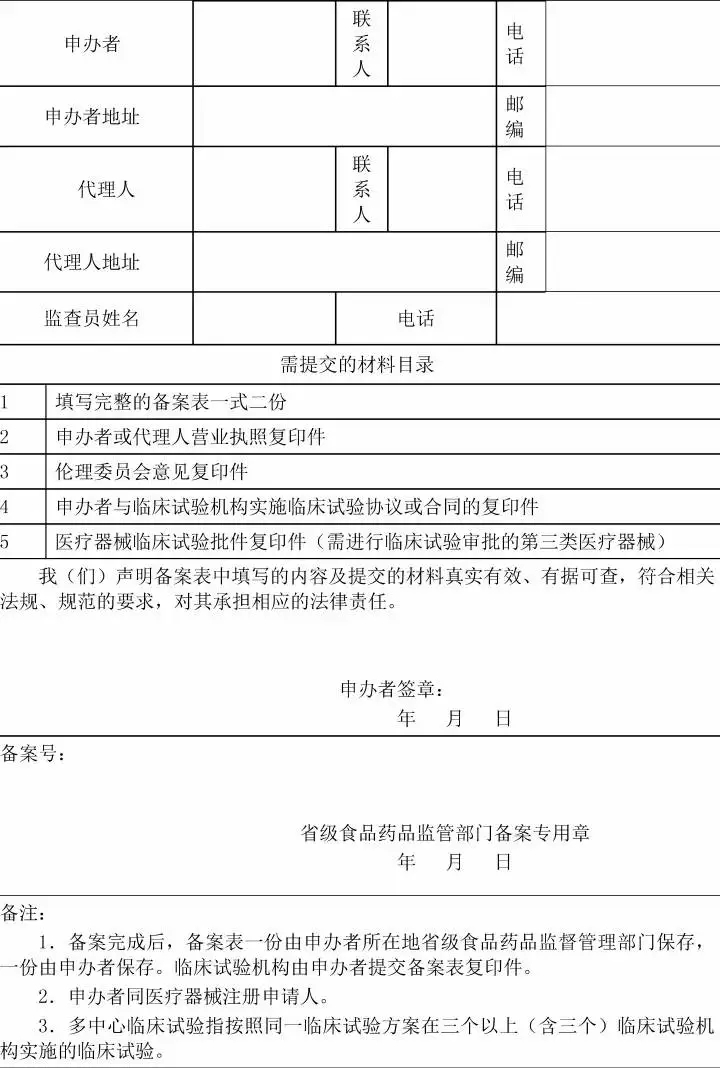
一、开展医疗器械临床试验,申办者应当在试验项目经伦理审查通过并与临床试验机构签订协议或合同后,填写《医疗器械临床试验备案表》(附件1),提交备案表中列出的相关材料,其中境内医疗器械向申办者所在地省级食品药品监督管理部门备案,进口医疗器械向代理人所在地省级食品药品监督管理部门备案。 二、接受备案的省级食品药品监督管理部门,对《医疗器械临床试验备案表》填写完整且提交材料齐全的,应当当场备案。备案号编排方式为:X1械临备XXXX2XXXX3,其中X1为备案部门所在地简称,XXXX2为年份,XXXX3为流水号。 三、接受备案的省级食品药品监督管理部门,应当在10个工作日内将备案信息(格式见附件2)通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。 四、自公告发布之日起,开展医疗器械临床试验应当按照本公告备案后实施。 五、申办者完成临床试验备案后,对试验项目起止日期有变化的,应当于变化后10个工作日内告知原备案管理部门并留有信息变更的记录。 六、食品药品监督管理部门应当加强对医疗器械临床试验备案工作的监督检查,对违反规定的依法查处。
接受备案的省级食品药品监督管理部门应当每月10日前将备案信息以电子邮件方式报送国家食品药品监督管理总局医疗器械注册管理司(电子信箱:mdct@cfda.gov.cn[/url])。 特此公告。 医疗器械临床试验备案表

CMDRA
|  /3
/3 