金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
《医疗器械分类规则》已经自2016年1月1日起施行,国家食药总局也在紧锣密鼓地开展《医疗器械分类目录》修订工作,预计新版《目录》今年出台。
中国医疗器械在3月初时曾披露,新版《目录》将2002版目录原有43个子目录调整为22个子目录,而且CFDA已经初步完成第一批11个子目录的修订。
不过,最新消息是,全部22个子目录初稿的编制和注册信息关联等工作在3月下旬就都已经初步完成了。
CFDA医疗器械标管中心3月21日在北京召开分类目录修订工作共性及专项问题专家研讨会,会上已经对分类目录修订稿进行初步汇总。标管中心副主任张志军要求,保证在6月底如期完成送审稿。
3月29-30日,CFDA医疗器械标管中心又在北京举办了“临床检验医疗器械分类目录(修订稿)研讨会”。会上传出消息,根据进度安排,4月中旬临床检验医疗器械分类目录(修订稿)将进入公示期。
据中国医疗器械了解,临床检验医疗器械分类目录正是第一批修订完成的11个子目录中的一个。该目录是由北京医疗器械质量监督检验中心负责的。
新的22临床检验器械子目录将由2002版目录中的6840和6841两大子目录合并而成。
旧版《医疗器械分类目录》的43个子目录
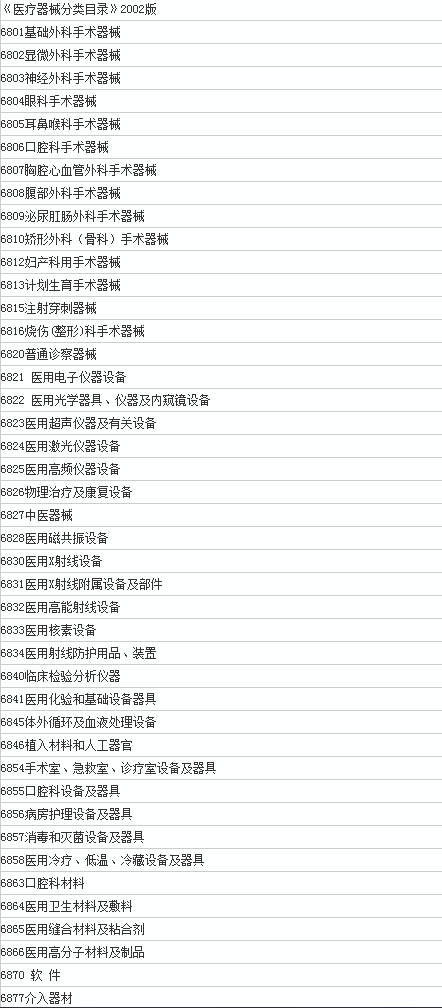
如上表,旧版6840对应的是临床检验分析仪器,6841对应的则是医用化验和基础设备器具。
合并后,产品类别的划分进一步细化,由原来的12个一级目录细化为16个一级目录、100多个二级目录。并对每个二级目录进行了产品描述和预期用途方面的描述。
新版临床检验器械子目录在一级目录上的变化
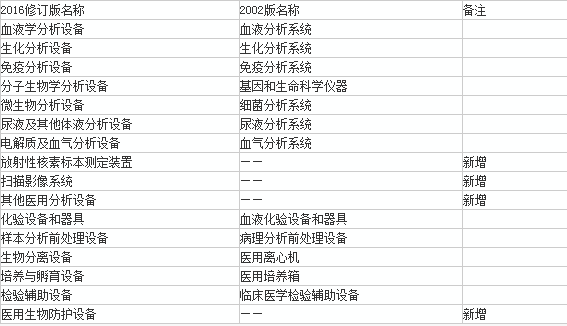
而且,有3类产品的风险和管理类别也进行了调整。
血库分析系统,包含ABO/RhD血型定型、结果判读功能,由Ⅱ类升为Ⅲ类。
全自动免疫分析仪的风险按照方法学评价,不以设备的全自动或半自动程度评价,将免疫分析设备统一由Ⅲ类降为Ⅱ类。
结核杆菌分析仪、药敏分析仪,虽然在2002版目录中是Ⅲ类,但目前的产品注册基本都是按照Ⅱ类批复的,降为Ⅱ类。
从以上调整中可以看出来,新版子目录与2002版相比,变化还真是挺大的。临床检验器械如此,其他的子目录也一样。
此外,与临床检验器械同在第一批的子目录还有医用软件、中医器械产品、妇产科、辅助生殖和避孕器械、眼科器械、患者承载器械、无源植入器械、有源植入器械、消毒灭菌器械、放射治疗器械、骨科手术器械、无源手术器械。
目前尚不清楚,这些分类子目录的修订稿是否会与临床检验医疗器械分类目录修订稿一起,在4月中旬进入公示期。不过,从6月就要把汇总后的新版《医疗器械分类目录》送审这个时间点来看,可能性很大。
CFDA曾明确,医疗器械分类与命名和编码一起构成监管的基础和源头,而分类又是《目录》优先于《医疗器械分类规则》。
新版《目录》的发布将明确一些产品的归属,直接指导企业的研发注册以及生产。各子目录中的产品描述、预期用途、品名举例等内容,也将指导企业对产品进行正确分类,以便于企业日后布局市场。
风险类别的调整更是决定了企业的相关产品是会被“加压”管理,还是“松绑”。
我国对Ⅰ类医疗器械实行备案管理,Ⅱ类由省一级药监部门实施产品注册管理,Ⅲ类由国家总局实施产品注册管理。在经营方面,Ⅰ类产品既不用获得许可,也不实施备案,Ⅱ类产品的经营实行备案管理,Ⅲ类则实行许可管理。按照风险程度由低到高,宽严有别。
如今,公示期就要来了,一旦进入,就真的距离《目录》出台只差临门一脚了。医械人们,你们做好迎接随之而来的产品注册、经营许可及监管方向上的变化了吗?
来源:中国医疗器械
|
|
 /3
/3 