| 2017年2月14日,本应沉浸在玫瑰花浓情氛围中的大众,傍晚却被金正男的死讯抓住了眼球;与之相比,国家食品药品监督管理总局于同日发布的《关于医疗器械经营企业检查结果的通告(2017年第22号)》吸睛能力自然减弱,但对于医械经营同行们而言,果真如此吗? 医械监管思路怎么变? 当我们仔细阅读相关内容后,留下最深刻印象的莫过于以下两段: “国家食品药品监督管理总局已要求相关省级食品药品监督管理局对上述企业的违法经营行为立案调查,依法严肃处理。情节严重的,责令停业,直至吊销《医疗器械经营许可证》。构成犯罪的,依法追究刑事责任。对上述违法经营案件,国家食品药品监督管理总局将进行督办。” “国家食品药品监督管理总局已要求相关省级食品药品监督管理局责令上述企业限期整改,并监督企业切实整改到位。” “严肃”、“责令”、“吊销”等这些词儿对从业者形成了强烈的视觉冲击,这次“国家队”(国家食品药品监督管理总局)又是什么套路?笔者分析后,试与读者做出如下分享—— 1、承上启下,逐步推动 从业者肯定不会忘记2016年的112号公告(医疗器械经营企业自查),那无疑意味着“国家队”要对整个行业开始摸底排查,完毕后,为了验证各“省队”“市队”(各省市食品药品监督管理局,下同)工作成果,马上组织飞行检查,对2016年的工作有了总结;接着选择在2017农历年初的节点发布该内容,在保证公告广泛性和有效性的同时又起到警醒作用(恕笔者直言,大部分企业员工只有在2月14日之后,才基本进入工作状态)。 2、监管层与从业者两手抓 此公告涉及企业囊括广东省(2家)、黑龙江省(1家)、北京市(1家)、吉林省(1家)、江苏省(2家)、贵州省(1家)、天津市(2家)、上海市(2家)及湖南省(1家)等一系列医药、器械的经营大省,被飞检省份的某些企业甚至存在十多项未符合要求的条款(《医疗器械经营质量管理规范》),对经营者的高压态势自不必说,但换个角度想,各“省队、市队”看到自己管辖区域内被飞检的企业,有没有羞愧和被打脸的感觉呢?所以,其实监管部门压力也是不小的。那么,情人节之后,各地的监管态势将如何转变自不必说了。 3、飞检重点开始转向 若各位不太经常关注总局网站医疗器械的飞行检查模块的话,不妨现在进入国家药监局网站看看2016年的飞检公告,违规的大多为医疗器械生产企业,而此时飞检矛头却突然转向经营企业,方向重点自不必说。 再者,熟悉法规的读者应该知道,针对医疗器械经营行业,国家做法大概如下: 2013-2014:开始逐步健全和规范法规内容 2015:法规推广年 2016:摸底排查,源头开刀(注册和生产) 那么2017呢?必定开始优化行业结构。优化中一个重要的方向必定要淘汰,而飞行检查又恰好是淘汰的有效手段,不是吗? 医械飞检内容怎么变? 谈完意图,不妨聊聊检查内容。 我们以CFDA关于益善生物技术股份有限公司等13家医疗器械经营企业检查结果的通告(2017年第22号)中广东合鑫生物科技有限公司的违规条款为例: 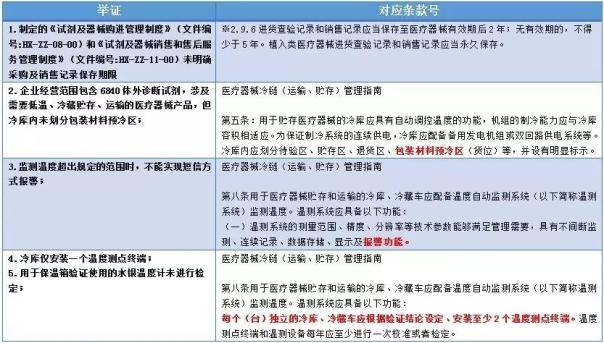    仔细分析该企业的违规条款,会发现如下特点: 1、核查趋向细致 被查企业中大多涉及了质量体系文件中很细化的内容,以不幸运的广东合鑫生物科技有限公司为例,被查到“制定的《试剂及器械购进管理制度》(文件编号:HX-ZZ-08-00)和《试剂及器械销售和售后服务管理制度》(文件编号:HX-ZZ-11-00)未明确采购及销售记录保存期限”。 从总局写法来看,明显是逐字逐句的看过质量管理制度才得出的结论,而在此之前,核查深度远没有如此,所以,“同一片天空,同一套制度”或“同一个省份,两三套模板”也许要成为过去了。 2、冷链核查范围广 8家被严肃处理的企业中,2家因冷链管理不善都被下条款,且检查范围不只于《医疗器械经营质量管理规范》,还涉及易被忽略的《医疗器械冷链(运输、贮存)管理指南》;比如某企业“未制定冷链管理的医疗器械在贮存、运输过程中温度控制的应急预案”这条违规项,是出自《医疗器械冷链(运输、贮存)管理指南》第九条。所以,经营冷链产品的企业,要提防法规的“组合拳”哦。 3、凸显“七大关键” 纵看这个公告,通篇把握了七个关键点,如下: 1.合法性:人员、仓储与经营地址 2.制度规定:有没有,是否实际 3.冷链与设备验证与校准(注:校准的范畴不仅冷链设备,常温计量设备也需要) 4.“四大记录”:采购、验收、出库复核与销售 5.首营资质审核:有没有,是否记录,是否可控 6.计算机系统:是否完善 7.不合格品处理:销毁相关记录 所以,个人认为,企业从这几个点着手对自身开始整改,应该是个好方法。 行业发展总有亘古不变的套路——初期的懵懂,情人的蜜月,家庭的束缚。 |
 /3
/3 