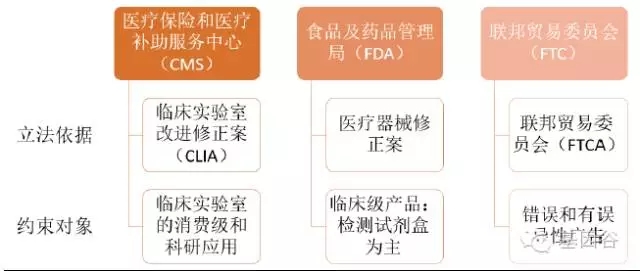
图 :美国参与监管的主要机构
美国基因测序产业由医疗保险和医疗补助服务中心(CMS)、食品及药品管理局(FDA)和联邦贸易委员会(FTC)共同监管。CMS 主要通过《临床实验室改进法案修正案》(CLIA)监管消费级和科研级应用,FDA 负责临床级产品的审批,FTC 负责监管其中错误和有误导性的产品宣传。美国有近80%的实验室通过了CLIA 认证,意味着这些临床实验室试验结果的准确性、可靠性和时效性都将得到CLIA 认可,从而为其承接更多临床试验项目铺平道路,也意味着CLIA 实验室能够根据市场的现实需求,快速地开发实验室自建项目,并通过在临床上的应用给予可靠的临床指导。CLIA 认证解决了基础研究和临床应用之间低效率转化甚至脱节的问题,对转化医学和研究成果转化有非常重要的意义。美国大部分液态活检公司都是走CLIA 认证,而非FDA 认证。中国也借鉴了这种方式来规范国内基因检测公司的竞争。
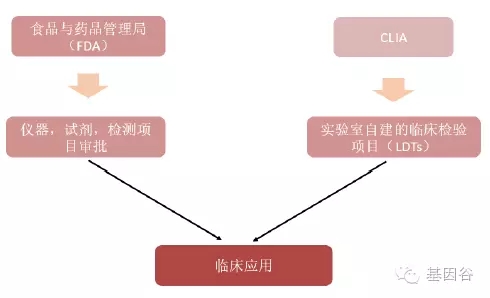
图 :美国基因检测项目进入临床的途径
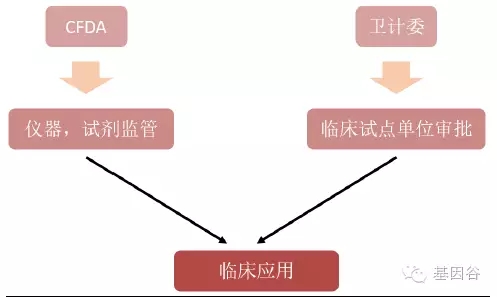
图 :中国基因检测项目进入临床的途径
国内的基于基因检测的液态活检项目进入临床也实行双重监管,所有仪器设备,试剂归CFDA 报批管理,临床实验归属卫计委管理。这与美国CLIA 认证制度类似。即要求试点单位内部有严格的质量控制,并且相关工作人员需经培训合格上岗,则不受CFDA 对仪器和试剂的注册限制。根据CFDA 在2014 年1 月公布的《食品药品监管总局办公厅关于基因分析仪等三个产品分类界定的通知》,基因测序诊断产品(包括基于测序仪及相关诊断试剂和软件),符合医疗器械的定义,应作为医疗器械管理,其中测序反应通用试剂盒(测序法)划为I 类医疗器械管理产品,基因测序仪作为III 类医疗器械管理。
表 :第一批肿瘤诊断与治疗项目高通量基因测序技术临床试点单位名单 
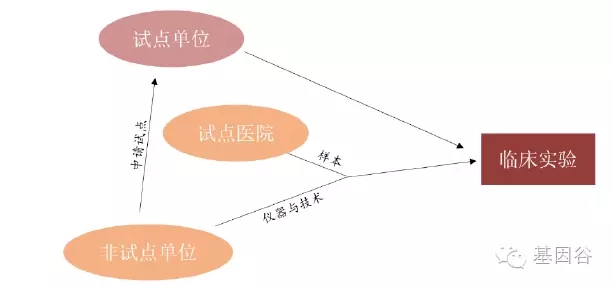
图 :液态活检的业务模式
2015 年3 月,国家卫计委医政医管局公布首批肿瘤高通量基因测序临床应用试点单位名单,只有试点单位具有出具诊断报告的资质,企业仍然可以以科研的形式开展测序服务。其中包括4 家第三方医学检验所华大、达安、博奥和湘雅。根据目前的国家政策,基于基因检测液态活检只有两种可能的业务模式:1、国家批准的临床应用试点单位(主要是第三方医学检验所)自己进行临床实验;2、不具有试点资格的企业通过与医院合作,获取医院将样品外包给企业或者企业产品投放到医疗机构。2016 年4 月,国家发展和改革委员会下发了《关于第一批基因检测技术应用示范中心建设方案的复函》(发改办高技„2016‟534 号),正式批复27 个省市发改委关于基因检测技术应用示范中心的建设方案。这些单位太多,我们没有一一列举,但从审批进度上看,未来示范单位的审批已经逐渐放开。目前国内有近百家以ctDNA 为检测对象的液态活检公司和大量基于组织活检的基因检测公司。但是,具有临床试点资质的医院比较少,样本资源有限,是各大公司争抢的对象。我们认为,未来液态活检将会有一个大的整合阶段,那些能够占领渠道和临床资源的大公司将在竞争中处于优势地位,并且有望通过整合其他公司而发展壮大。 |  /3
/3 