1
"CFDA"成历史!国家药监局变更为"NMPA"
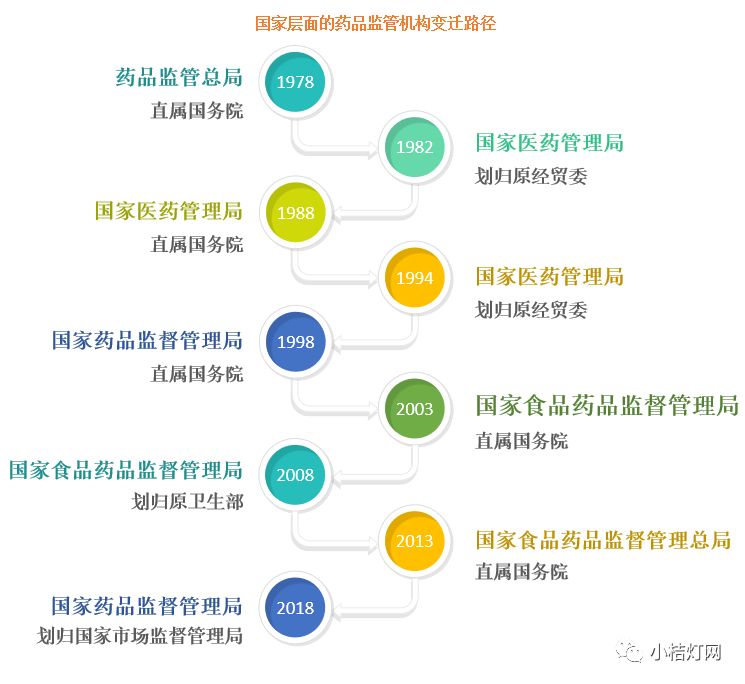
2018年3月13日国务院机构改革方案公布,国家食品药品监督管理总局(China Food and Drug Administration,简称CFDA)改名为国家药品监督管理局(National Medical Products Administration,简称NMPA),由国家市场监督管理总局管理,国家食品药品监督管理总局(CFDA)则不再保留。有人戏剧性解读“NMPA”为“你 (N) 们 (M) 批 (P) 啊 (A) ”。
在改革开放40年来,国家层面的药品监管机构历经了多次变迁。
2
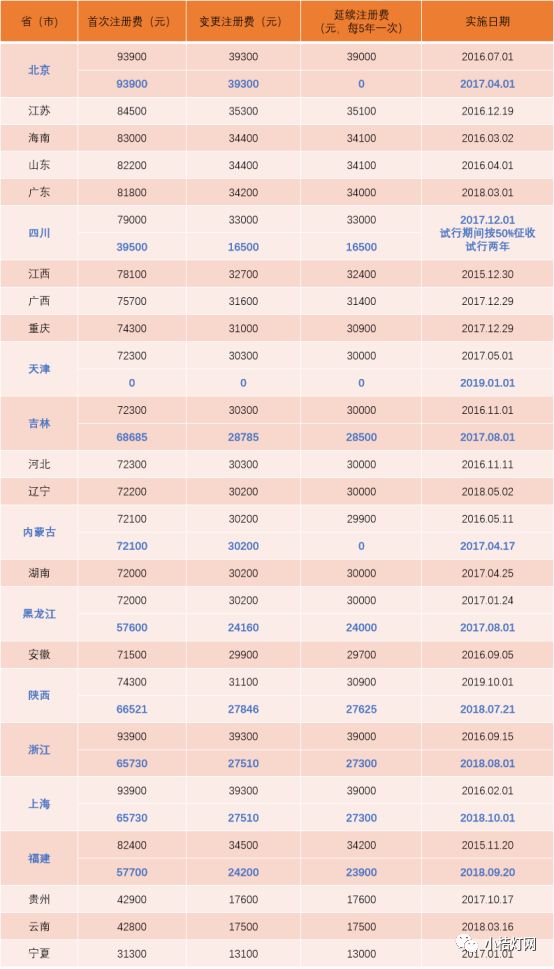
各省(市)医疗器械注册收费降价
国家食品药品监督管理总局于2015年5月27日发布《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)》,制定了医疗器械注册收费标准。各省(市)也随之制定了省局负责审批的第二类国产医疗器械注册事项收费标准,为减轻企业负担,截止2019年1月1日,已有10个省(市)相继降低了收费标准,目前24个省市收费标准如下:
3
医疗器械上市许可持有人制度向全国辐射
在2014年10月1日施行《医疗器械生产监督管理办法》之前,医疗器械生产企业必须先办理生产许可证再注册产品,虽然在保障产品质量方面发挥了积极作用,但生产企业在取得生产许可到完成产品注册这一过程中,容易造成企业人员、场地和设备的闲置,加大了企业负担。该办法实施之后,转变为医疗器械生产企业先注册产品再办理生产许可,这种监管模式的改变,既进一步鼓励企业创新,又减少了企业在产品获得注册前资金和人员的投入。
但是无论是新条例实施前还是实施后,法规都明确要求了生产企业必须取得生产许可证和产品注册证,即生产许可证与产品注册证必须由同一个主体完成。在此制度之下,申请人若没有企业依然不能申报注册产品,行业的创新性仍然被束缚。而医疗器械上市许可持有人制度的出现,则完全打破了这一局面,实现了企业与产品的解绑。
作为首个试点医疗器械上市许可持有人制度的地区,上海为全国提供了先行经验,并于2018年2月27日有了首个落地产品。5月,广东自贸区与天津自贸区被国务院批准成为该制度的试点区域。2018年6月25日司法部发布的《医疗器械监督管理条例修正案》(草案送审稿)规定取得备案凭证或者医疗器械注册证的,为医疗器械上市许可持有人。确立了医疗器械上市许可持有人制度的法律地位,并预示着将在全国施行。
4
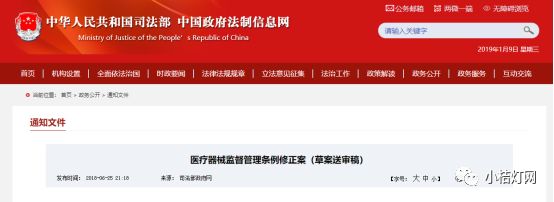
《医疗器械监督管理条例修正案 (草案送审稿)》公开征求意见
2018年6月25日,司法部公布《医疗器械监督管理条例修正案(草案送审稿)》,面向社会征集意见。医疗器械监督管理条例的修改,必将迎来医疗器械行业的巨变,虽然只是草案送审稿,但医疗器械行业的改变已势不可挡。修正案中最值得关注的有以下几点:一是明确了医疗器械上市许可持有人制度并将在全国范围实施;二是改革临床试验管理制度。(第一类医疗器械产品备案,不需要进行临床评价;申请第二类医疗器械产品注册,原则上不需要进行临床评价;申请第三类医疗器械产品注册,应当进行临床评价);三是放开注册检测,产品检验报告可以是医疗器械注册申请人或者备案人的自检报告或者委托有资质的医疗器械检验机构出具的检验报告;四是取消医疗器械广告事前审批,改为事后监管;五是罚款标准大幅增加,增加处罚到人规定。
5
免于临床试验医疗器械目录范围进一步扩大
2018年9月28日,国家药品监督管理局发布了《关于公布新修订免于进行临床试验医疗器械目录的通告(2018年第94号)》,组织对前期已发布的三批免于进行临床试验的医疗器械(含体外诊断试剂)目录进行了修订和汇总,实施最新且是目前唯一的《免于进行临床试验的医疗器械目录(修订)》《免于进行临床试验的体外诊断试剂目录(修订)》,目录中包含了855项医疗器械和393项IVD产品。
此前发布的《关于发布免于进行临床试验的第二类医疗器械目录的通告》(2014年第12号)、《关于发布免于进行临床试验的第三类医疗器械目录的通告》(2014年第13号)、《关于发布第二批免于进行临床试验医疗器械目录的通告》(2016年第133号)、《关于发布第三批免于进行临床试验医疗器械目录的通告》(2017年第170号)同时废止。
为了进一步规范免于进行临床试验的体外诊断试剂同品种比对研究,提高其科学性与合理性,医疗器械技术审评中心对《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》(国家食品药品监督管理总局通告 2017年第179号)进行了修订,形成了《免于进行临床试验的体外诊断试剂同品种比对技术指导原则(征求意见稿)》。
6
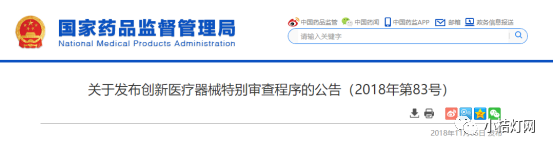
《创新医疗器械特别审查程序》正式稿发布
为鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动医疗器械产业高质量发展,2018年11月2日,国家药品监督管理局发布了《关于发布创新医疗器械特别审查程序的公告(2018年第83号)》,自2018年12月1日起施行。原国家食品药品监督管理总局印发的《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)同时废止。
自2014年3月1日起施行《创新医疗器械特别审批程序(试行)》以来,已有200余项医疗器械产品通过了创新医械特别审批程序,并且审批数量呈逐年上涨的趋势,其中IVD产品占比超过20%。与试行稿相比,正式稿对制定依据、适用情形、申报时间、接收审查单位等都作了更为明确的修订。
为了进一步做好创新医疗器械申报资料编写和技术审查工作,国家药品监督管理局组织制定了《创新医疗器械特别审查申报资料编写指南》并于2018年12月12日发布,原指南同时废止。
除了上文提到的以外,监管法规方面的变化还有:《医疗器械临床试验机构条件和备案管理办法》自2018年1月1日起施行,2019年1月1日起,医疗器械(包括体外诊断试剂)临床试验申办者需选取已经在备案系统备案的医疗器械临床试验机构开展有关试验;新修订的《医疗器械分类目录》自2018年8月1日起施行;国家市场监督管理总局和国家卫生健康委员会于2018年8月13日联合发布《医疗器械不良事件监测和再评价管理办法》;国家药品监督管理局于2018年9月29日发布《医疗器械生产企业管理者代表管理指南》等等
整理:小桔灯网丨作者:面气灵













 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


