国产Ⅲ类IVD延续注册咨询服务流程图
2018-7-5 00:00|
编辑: 小桔灯网|
查看: 1424|
评论: 0|来源: 奥咨达高级研修中心
摘要: 体外诊断试剂简介体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人 ...
体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本进行体外检测的试剂、试剂盒、校准品、质控品等。
体外诊断试剂的分类按检测原理或检测方法分类主要有生化诊断试剂、免疫诊断试剂,分子诊断试剂、微生物诊断试剂、尿液诊断试剂、凝血类诊断试剂、血液学和流式细胞诊断试剂等,其中生化、免疫、分子诊断试剂为我国诊断试剂主要的三大类品种。
根据产品风险程度的高低,体外诊断试剂依次分为第三类、第二类、第一类产品。
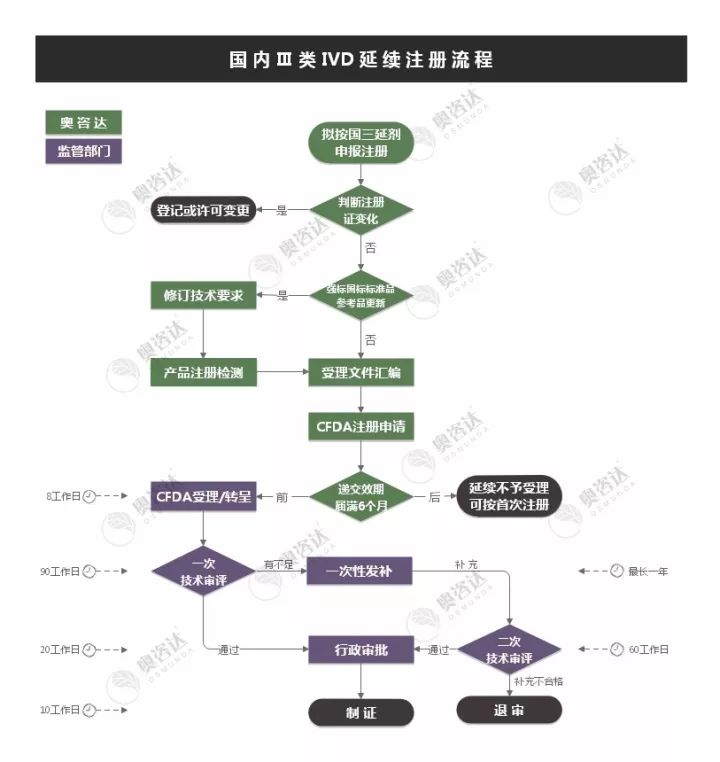
(图片可点击放大)
主管部门 | 管理类别 | 延续注册 (五年一次) (万元) | 国家局 | 境内 | III | 4.08 |
资料收集(客户提供资料;新标准指南文献检索;变更判断) 1个月
产品技术要求修订,预算估计至少20个工作日 1个月
*产品检测(如需),约6个月。 *6个月
延续注册申报资料编制 2-3个月 CFDA法定消耗预算7个月。(128工日,20工日/月,不计节假) 至少7个月
*发补(如适用):1、发补资料准备时限0~12个月视产品递交的申报资料情况而定。 *平均6个月
*发补(如适用):2、发补技术评审时间预计消耗3个月(60工作日) *3个月 |
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 