器审中心老师杭州授课,课后深度总结
2017-10-14 00:00|
编辑: 小桔灯网|
查看: 1852|
评论: 0|来源: 迈迪思创
摘要: 概述篇1.第二类、第三类体外诊断试剂注册需要进行临床试验,校准品,质控品除外。是否需要进行临床试验根据具体用途。例如:2. 涉及临床试验的变更事项主要原材料供应商变更;变更检测条件;阳性判断值或参考区间; ...
概述篇 1. 第二类、第三类体外诊断试剂注册需要进行临床试验,校准品,质控品除外。是否需要进行临床试验根据具体用途。例如: 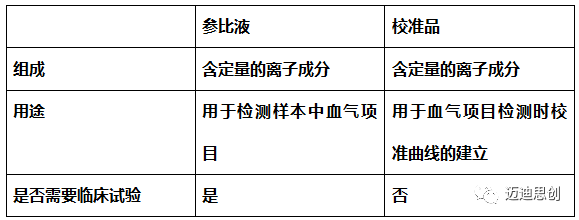
2. 涉及临床试验的变更事项 主要原材料供应商变更; 变更检测条件; 阳性判断值或参考区间; 增加临床适应症; 新增样本类型。
3. 新研制产品临床试验设计 参照系统选择:“金标准”如:组织病理检查、影像学、病原体分离培养鉴定、长期随访等。 受试者入排标准,根据预期用途、适用人群确定入组、排除标准; 病例组:随机入组,均匀分布。“金标准”确定有某病,包括症状典型和非典型,病程早、中、晚期,病情轻、中、重型,不同性别、年龄等; 对照组:“金标准”确定无该病患者和/或正常人,包括易混淆疾病病例。
4. 新研制产品临床试验设计 最低样本量要求(产品注册):三类为1000例,二类为200例,特殊情况如下, 5. 注册变更最低样本量要求 产品篇
1. 结核类产品

(1) 临床样本的选择 (2) 样本量 (3) 试验方案 (4) 临床试验数据 2. 血型类产品
图说 流行性感冒病毒核算 

答疑解惑篇
1. 常见问题分析 配套仪器 试剂临床试验时如其配套仪器尚未上市,可以作为试验用配套仪器一同进行临床试验。但同步开展试验应注意试剂和仪器注册申报临床评价资料的要求和临床试验具体要求的差异。 试剂批次 临床试验中试验用体外诊断试剂与注册检验用体外诊断试剂可以为不同批次,整个临床试验过程中试验用体外诊断试剂可以为不同批次。 数据统计分析 不同样本类型分别统计;多项联检、多基因型联检,不同检测项目/基因型分别统计;检测范围较宽时分段统计;不同人群分层统计。 测序技术的应用 测序数据应由临床试验机构负责,应提交详细的测序试验方法学和检测数据;如临床机构不能完成测序实验,可委托有资质和能力的第三方机构,提交有关的委托协议/合同。
图说 同品种对比 
2. 老师现场解答 |
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 